��Ŀ����
19��������N2H4��������������һ����Ҫ�Ļ��ȼ�ϣ�N2H2��N2O4��Ӧ�ܷų��������ȣ���1����֪��2NO2��g��?N2O4��g����H=-57.20KJ•mol-1����һ���¶��£������ܱ������з�Ӧ�ﵽƽ�⣮������������ʱ�����д�ʩ�����NO2ת���ʵ���BC
A����СNO2��Ũ��B�������¶� C������NO2��Ũ��D�������¶�
��2����֪��T�棬2L�ܱ������У�����4mol NO2��g��������5min��Ӧ��ƽ��ʱ���ų�������Ϊ57.20KJ�����ʱN2O4���������Ϊ33%���ڴ�ʱ������N2O4��ʾ�ķ�Ӧ����Ϊ0.1mol/��L��min�����ﵽƽ������¶Ȳ��䣬������С�����������1L���������ɫ�仯�������ȼ�����dz������ԭ����Ҫ��
��3��25��ʱ��1.00g N2H4��1��������N2O4��l����ȫ��Ӧ����N2��g����H2O��l�����ų�19.14kJ����������Ӧ2N2H4��l��+N2O4��l��=3N2��g��+4H2O��l���ġ�H=-1224.96 kJ•mol-1��
��4��17�桢1.01��105 Pa���ܱ�������N2O4��NO2�Ļ������ﵽƽ��ʱ��c��NO2��=0.0300mol•L-1��c��N2O4��=0.0120mol•L-1����Ӧ2NO2��g��?N2O4��g����ƽ�ⳣ��K=13.3
��5��T�桢1.01��105 Pa����֪��Ӧ2NO2��g��?N2O4��g����ƽ�ⳣ��K=$\frac{1}{3}$����2L�ܱ������У�����10mol NO2��g�� ��4mol N2O4��g������ƽ��������N2O4���ʵķ����ƶ����ٴ�ƽ��ʱ��NO2��g����Ũ����3mol/L��
���� ��1��A����СNO2��Ũ�ȣ���ЧΪ����ѹǿ��ƽ�������ƶ���
B������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���
C������NO2��Ũ�ȣ���ЧΪ����ѹǿ��ƽ�������ƶ���
D������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���
��2�����ݷų��������������ɵ�N2O4�����ʵ������μӷ�ӦNO2�����ʵ�������������N2O4���������������v=$\frac{��c}{��t}$��������N2O4��ʾ�ķ�Ӧ���ʣ�
�ﵽƽ������¶Ȳ��䣬������С�����������1L����������Ũ��������ɫ���ѹǿ����ƽ�������ƶ�����ɫ�ֱ�dz������������Ũ�ȱ�ԭ����
��3������2mol N2H4��Ӧ�ų��������ɵ÷�Ӧ�ȣ�
��4������K=$\frac{c��{N}_{2}{O}_{4}��}{{c}^{2}��N{O}_{2}��}$����ƽ�ⳣ����
��5�������ʱŨ����Qc����Qc=K������ƽ��״̬����Qc��K����Ӧ������Ӧ���У���Qc��K����Ӧ���淴Ӧ���У�
��ƽ��ʱNO2��g����Ũ��Ϊxmol/L����ʾ��ƽ��ʱN2O4��Ũ�ȣ��ٽ��ƽ�ⳣ���з��̼��㣮
��� �⣺��1��A����СNO2��Ũ�ȣ���ЧΪ����ѹǿ��ƽ�������ƶ���NO2ת���ʼ�С����A����
B������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���NO2ת��������B��ȷ��
C������NO2��Ũ�ȣ���ЧΪ����ѹǿ��ƽ�������ƶ���NO2ת��������C��ȷ��
D������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���NO2ת���ʼ�С����D����
��ѡ��BC��
��2�����ɵ�N2O4�����ʵ���Ϊ$\frac{57.20kJ}{57.20kJ/mol}$=1mol���μӷ�ӦNO2Ϊ1mol��2=2mol��5minƽ��ʱNO2Ϊ4mol-2mol=2mol��N2O4���������Ϊ$\frac{1mol}{1mol+2mol}$��100%=33%��N2O4��ʾ�ķ�Ӧ����Ϊ$\frac{\frac{1mol}{2L}}{5min}$=0.1mol/��L��min����
�ﵽƽ������¶Ȳ��䣬������С�����������1L����������Ũ��������ɫ���ѹǿ����ƽ�������ƶ�����ɫ�ֱ�dz������������Ũ�ȱ�ԭ�����������ɫ�仯�����ǣ��ȼ�����dz������ԭ����Ҫ�
�ʴ�Ϊ��33%��0.1mol/��L��min�����ȼ�����dz������ԭ����Ҫ�
��3��2mol N2H4��Ӧ�ų�������Ϊ19.14kJ��$\frac{2mol��32g/mol}{1.00g}$=1224.96kJ����Ӧ2N2H4��l��+N2O4��l��=3N2��g��+4H2O��l���ġ�H=-1224.96 kJ•mol-1��
�ʴ�Ϊ��-1224.96��
��4��ƽ��ʱ��c��NO2��=0.0300mol•L-1��c��N2O4��=0.0120mol•L-1����Ӧ2NO2��g��?N2O4��g����ƽ�ⳣ��K=$\frac{c��{N}_{2}{O}_{4}��}{{c}^{2}��N{O}_{2}��}$=$\frac{0.012}{0.0{3}^{2}}$=13.3��
�ʴ�Ϊ��13.3��
��5����2L�ܱ������У�����10mol NO2��g�� ��4mol N2O4��g����Ũ����Qc=$\frac{\frac{4}{2}}{��\frac{10}{2}��^{2}}$=0.08��K=$\frac{1}{3}$����Ӧ������Ӧ���У���������N2O4�ķ����ƶ���
��ƽ��ʱNO2��g����Ũ��Ϊxmol/L����
2NO2��g��?N2O4��g��
��ʼŨ�ȣ�mol/L����5 2
�仯Ũ�ȣ�mol/L����2x-4 x-2
ƽ��Ũ�ȣ�mol/L����9-2x x
��$\frac{x}{��9-2x��^{2}}$=$\frac{1}{3}$�����x=3��
�ʴ�Ϊ��N2O4��3mol/L��
���� ���⿼�黯ѧƽ�������Ӱ�����ء���ѧ��Ӧ���ʡ���ѧƽ�ⳣ������Ӧ�ȼ���ȣ�ע���������ջ�ѧƽ�ⳣ����Ӧ�ã�

 ��������ϵ�д�
��������ϵ�д�| ��� | ���� | �Լ���������� |
| �� | �����ʣ�NaHCO3��Һ��Na2CO3�� | |
| �� | �����ʣ�MgO��Al2O3�� | |
| �� | �����ʣ�FeCl2��Һ��FeCl3�� | |
| �� | ����NaCl��KCl | |
| �� | ����AlCl3��Al2��SO4��3��Һ |
| A�� | ����ʽΪC7H8O���Һ��������л���������4�� | |
| B�� | �Ҵ���ʹ���Ը��������Һ��ɫ | |
| C�� | ����ˮ�Ҵ��м���ŨH2SO4��������170�棬������ʹ����KMnO4��Һ��ɫ������ֻ����ϩ | |
| D�� |  ��FeCl3��Һ������ɫ ��FeCl3��Һ������ɫ |
| A�� | ��������ԭ�Ӳ�ȡsp3�ӻ��ķ��ӣ������幹�Ͷ������������� | |
| B�� | ��SCl2�У�����ԭ��S��ȡsp�ӻ�����ɼ� | |
| C�� | �ӻ����ֻ�����γɦҼ�����������δ����ɼ��ŵ��Ӷ� | |
| D�� | ��AB3�͵Ĺ��ۻ����������ԭ��A������sp3�ӻ�����ɼ� |
| A�� | һ�����ڵ�����ΪFe3+��SO42- | |
| B�� | һ�������ڵ�����ΪCO32-��I- | |
| C�� | ����ȷ��������ΪK+��SO42- | |
| D�� | ȷ���Ƿ���K+������Ҫ������ɫ��Ӧ |
| A�� | ���³�ѹ�£�28 g��ϩ�ͻ����飨C4H8���Ļ�������к��е�̼ԭ����Ϊ2 NA | |
| B�� | 4.2 g C3H6�к��е�̼̼˫����һ��Ϊ0.1 NA | |
| C�� | 1 mol-OH�е�����Ϊ10 NA | |
| D�� | ��״���£�2.24 L CHCl3��ԭ������Ϊ0.1 NA |

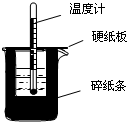 50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺