题目内容
1.硫酸亚铁(FeSO4•7H2O)是一种重要的食品和饲料添加剂.实验室通过如下实验由废铁屑制备FeSO4•7H2O晶体:①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;⑤将制得的FeSO4•7H2O晶体放在一个小广口瓶中,密闭保存.请回答下列问题:(1)写出Fe2+的核外电子排布式[Ar]3d6
(2)用轨道表示式表示Fe3+的3d电子的排布情况

(3)Fe(OH)3在碱性介质中与NaClO反应生成Na2FeO4和NaCl,ClO-的电子式是
 ,Fe(OH)3与NaClO反应的化学方程式是2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O.
,Fe(OH)3与NaClO反应的化学方程式是2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O.(4)硫酸亚铁制备中实验步骤①的目的是除去铁屑上的油污.
(5)实验步骤②明显不合理,理由是铁耗尽会使亚铁离子被氧化Fe3+.
(6)实验步骤④中用少量冰水洗涤晶体,其目的是洗涤晶体中混有的稀硫酸,减少洗涤过程中晶体的损耗.
分析 (1)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,根据构造原理写出亚铁离子核外电子排布式;
(2)根据铁离子的核外电子数,结合能量最低原则、泡利不相容原理和洪特规则,写出核外电子排布式,然后根据3d轨道含有的电子数写出其3d电子的排布情况;
(3)根据Fe(OH)3在碱性介质中与NaClO反应生成Na2FeO4和NaCl写出该反应的化学方程式;
(4)根据碳酸钠溶液为碱性溶液,能够除去油污进行分析;
(5)铁屑耗尽,不能防止亚铁离子被氧化;
(6)温度低,晶体的溶解度小.
解答 解:(1)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,Fe2+在基态时,核外电子排布式为:[Ar]3d6,故答案为:[Ar]3d6;
(2)Fe最外层电子数为26,失去3个电子后,核外电子数变为23,由于先失去最外层电子,可写出铁离子最外层电子排布式为:1s22s22p63s23p63d5,所以3d轨道含有5个电子,根据洪特规则,电子总是优先占据1个轨道,并且自旋方向相同,所以Fe3+的3d电子的排布情况是 ,
,
故答案为: ;
;
(3)Fe(OH)3在碱性介质中与NaClO反应生成Na2FeO4和NaCl,反应的化学方程式为:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O,ClO-的电子式是  ,故答案为:
,故答案为: ;2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O;
;2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O;
(4)Na2CO3溶液显碱性,可以除去铁屑上的油污,升高温度,促进了Na2CO3的水解,溶液碱性增强,去油污能力增强,
故答案为:除去铁屑上的油污;
(5)因亚铁离子易被氧化,加Fe可防止氧化,所以实验步骤②明显不合理,理由是铁耗尽会使亚铁离子被氧化成Fe3+,
故答案为:铁耗尽会使亚铁离子被氧化Fe3+;
(6)温度低,晶体的溶解度小,则少量冰水洗涤,可防止晶体溶解,故答案为:洗涤晶体中混有的稀硫酸,减少洗涤过程中晶体的损耗.
点评 本题考查了核外电子排布式、化学方程式的书写、物质的分离与提纯实验方案设计的评价,题目难度中等,注意掌握化学方程式、核外电子排布式的书写原则,试题有利于提高学生的分析、理解能力.

| A. | 胆矾--FeSO4•7H2O | B. | 钡餐--BaCO3 | ||
| C. | 明矾--KAl(SO4)2 | D. | 生石膏--CaSO4•2H2O |
| A. | 1-丁烯 | B. | 1-丁炔 | C. | 2-丁炔 | D. | 2-丁烯 |
| A. | 非金属元素的原子最外层电子数都大于或等于4 | |
| B. | 非金属元素的原子都易得电子生成相应的阴离子 | |
| C. | 非金属单质都是气体 | |
| D. | 每一主族所包含的元素中不一定都有非金属元素 |
| A. | 20.0 mL 18 mol•L-1 H2SO4溶液 | B. | 250.0 mL 2 mol•L-1 HCl溶液 | ||
| C. | 150.0 mL 2 mol•L-1 H2SO4溶液 | D. | 500.0 mL 3 mol•L-1 HCl溶液 |
| A. | 溶液c(H+)先变大后变小 | |
| B. | 溶液导电能力逐渐增强 | |
| C. | 氢硫酸完全反应生成1.6g硫 | |
| D. | 反应的离子方程式为:S2-+Cl2→2Cl-+S↓ |
| A. | 卤素单质的熔沸点随原子序数增大而升高,所以碱金属单质熔沸点也随原子序数增大而升高 | |
| B. | Na能与冷水反应,推测Cs也能与冷水反应 | |
| C. | Fe与Cl2反应生成FeCl3,推测Fe与S反应生成Fe2S3 | |
| D. | CO2不能与Ba(NO3)2反应,所以SO2也不能与 Ba(NO3)2反应 |
| A. | Na | B. | K | C. | Po | D. | Cu |
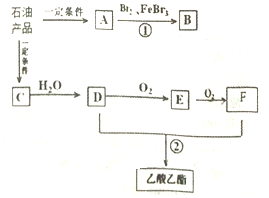 石油是一种重要的资源,其常压蒸馏的产品在一定条件下能转化为芳香烃.A-F均为有机化合物,C的产量可以用来衡量一个国家的石油化工发展水平.它们的转化关系如图所示(部分产物和反应条件已略去).
石油是一种重要的资源,其常压蒸馏的产品在一定条件下能转化为芳香烃.A-F均为有机化合物,C的产量可以用来衡量一个国家的石油化工发展水平.它们的转化关系如图所示(部分产物和反应条件已略去). ,反应类型为取代反应;
,反应类型为取代反应;