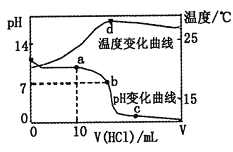
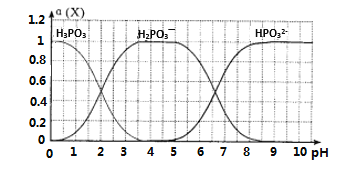
题目内容
【题目】某化学研究性学习小组将高锰酸钾粉末与一定量铁粉混合隔绝空气加热,并在实验结束后对所得产物中不溶于水的黑色粉末X进行探究。
(探究目的)分析黑色粉末X的组成,并进行相关实验。
(猜想与假设)该黑色粉末可能含有铁粉、二氧化锰、四氧化三铁中的一种或几种。
(初步认证)将磁铁靠近黑色粉末,部分被吸引。
(初步结论)黑色粉末中_______含有MnO2,;_______含有Fe;________含有Fe3O4(填“一定”、“可能”或“一定不”)。
(定性检验)
实验步骤 | 实验操作 | 实验现象 |
步骤一 | 取少量黑色粉末于试管中,加足量稀硫酸,微热 | 黑色粉末部分溶解,无气泡产生 |
步骤二 | 将步骤一反应后试管中的物质过滤,向滤液中滴加几滴KSCN 溶液,振荡 | 溶液呈现红色 |
步骤三 | 取步骤二所得滤渣于试管中,加足量浓盐酸,加热 | 滤渣全部溶解,有黄绿色气体产生 |
步骤三中产生气体的离子方程式为___________________________________________。
(定量检验)
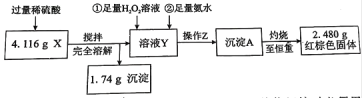
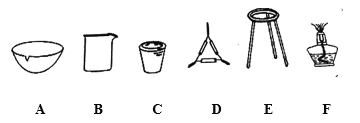
①操作Z的名称是__________,下图的仪器中,在灼烧沉淀时必须用到的是____________(填字母)。
②有同学认为:上述流程若不加入H2O2,其它步骤不变,只要在空气中充分放置仍可达到目的。他的理由是(用化学方程式表示)__________________________________________。
③通过以上数据,得出4.116 g黑色粉末X中各成分的物质的量为_________________。
【答案】一定 可能 一定 ![]() 过滤 CDEF
过滤 CDEF ![]() 0.01 mol Fe3O4、0.02 mol MnO2
0.01 mol Fe3O4、0.02 mol MnO2
【解析】
铁和四氧化三铁都能被磁铁吸引,高锰酸钾和铁粉反应,根据元素守恒,产物中肯定含有二氧化锰,根据氧化还原规律,铁的化合价肯定升高,故肯定含有四氧化三铁,铁粉可能有剩余;步骤三中加入浓盐酸加热产生了氯气,是二氧化锰和浓盐酸反应产生了氯化锰、氯气、水;①根据流程图,操作Z分离出了沉淀,故操作Z是过滤;灼烧沉淀时需要用到坩埚、泥三角、三脚架、酒精灯等;②加入![]() 的作用是将亚铁离子氧化为铁离子,氧气也能起到这种作用;③根据定性检验可知黑色固体中不含铁粉,只含有二氧化锰和四氧化三铁,二氧化锰和硫酸不反应,四氧化三铁溶于硫酸,故1.74g沉淀是二氧化锰;四氧化三铁的质量为
的作用是将亚铁离子氧化为铁离子,氧气也能起到这种作用;③根据定性检验可知黑色固体中不含铁粉,只含有二氧化锰和四氧化三铁,二氧化锰和硫酸不反应,四氧化三铁溶于硫酸,故1.74g沉淀是二氧化锰;四氧化三铁的质量为![]() 。
。
铁和四氧化三铁都能被磁铁吸引,高锰酸钾和铁粉反应,根据元素守恒,产物中肯定含有二氧化锰,根据氧化还原规律,铁的化合价肯定升高,故肯定含有四氧化三铁,铁粉可能有剩余;
故答案为:一定;可能;一定;
步骤三中加入浓盐酸加热产生了氯气,是二氧化锰和浓盐酸反应产生了氯化锰、氯气、水,离子方程式为:![]() ;
;
故答案为:![]() ;
;
①根据流程图,操作Z分离出了沉淀,故操作Z是过滤;灼烧沉淀时需要用到坩埚、泥三角、三脚架、酒精灯等;
答案为:过滤;CDEF;
②加入![]() 的作用是将亚铁离子氧化为铁离子,氧气也能起到这种作用,方程式为:
的作用是将亚铁离子氧化为铁离子,氧气也能起到这种作用,方程式为:![]() ;
;
故答案为:![]() ;
;
③根据定性检验可知黑色固体中不含铁粉,只含有二氧化锰和四氧化三铁,二氧化锰和硫酸不反应,四氧化三铁溶于硫酸,故1.74g沉淀是二氧化锰,物质的量为:![]() ;四氧化三铁的质量为
;四氧化三铁的质量为![]() ,物质的量为:
,物质的量为:![]() ;
;
故答案为:0.01 mol![]() 、0.02 mol
、0.02 mol ![]() 。
。

【题目】阅读下面信息,推断元素,按要求回答问题:
信息 | 问题 |
①短周期元素X、Y、Z、W,原子序数依次增大,最外层电子数均不少于最内层电子数 | (1)X一定不是__ A.氢 B.碳 C.氧 D.硫 |
②一定条件下,上述四种元素的单质均能与足量的氧气反应,生成的氧化物有两种能溶于稀硫酸,三种能溶于浓NaOH溶液,氧化物的相对分子质量都大于26 | (2)这四种元素中有铝元素吗?__ |
③向上述四种元素的单质的混合物中,加入足量的盐酸,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中有白色沉淀 | (3)白色沉淀的化学式为__ |
④向上述四种元素的单质的混合物中,加入足量的烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸,最终溶液中有白色沉淀 | (4)生成白色沉淀的离子方程式为__ |
⑤X与W同主族 | (5)X的最高价氧化物的电子式为___ |