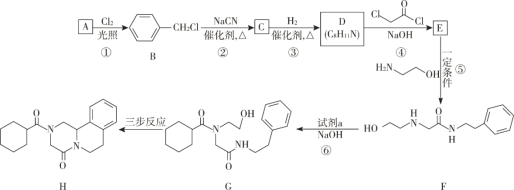
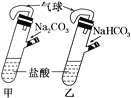
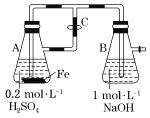
题目内容
【题目】钴、镍与铁是同族元素,它们的单质及化合物的性质有很多相似之处。
(1)为了比较 Fe、Co、Cu 三种金 属的活动性,某实验小组设计如下甲、乙、丙三个实验装置。 丙装置中 X、Y 均为石墨电极。反应一段时间后,可观察到甲装置中 Co 电极附近产生气泡,丙装 置中 X 极附近溶液变红。
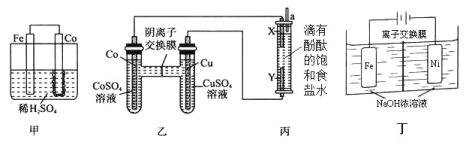
①由现象可知三种金属的活动性由强到弱的顺序是_________(填元素符号) 。
②请在如图框内设计实现“2Ag+Co(NO3)2 = Co+2AgNO3” 反应的装置。(在框内标注电源或者电流表、电极材料、电解质溶液。)_____________
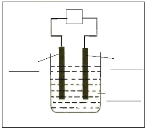
(2)Na2FeO4 具有广泛用途,可通过电解法制取得到,工作原理如图丁所示。通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。已知:Na2FeO4 只在强碱性条件下稳定,易被 H2 还原。
①Fe 电极反应式为_________。电解 一段时间后,溶液的 PH_____(填“增大”或“减小”或“不变”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_____。
【答案】Fe>Co>Cu  Fe6e+8OH=FeO42+4H2O 减小 防止阴极产生的H2与阳极生成的Na2FeO4反应降低产率
Fe6e+8OH=FeO42+4H2O 减小 防止阴极产生的H2与阳极生成的Na2FeO4反应降低产率
【解析】
(1)①甲池是原电池,Co电极附近产生气泡,即Co电极有H2生成,Co做正极,Fe做负极,说明Fe比Co活泼;乙池也是原电池,电解饱和食盐水,X极附近溶液变红,说明X电极周围有大量氢氧根,氢离子在X电极得电子变为氢气,X是阴极,即乙池Co电极为负极,说明Co比Cu活泼,所以三种金属的活动性由强到弱的顺序是 Fe>Co>Cu,
故答案为:Fe>Co>Cu;
②用电解法实现2Ag+Co(NO3)2=Co+2AgNO3,则Ag电极与电源正极连接,C或Co与电源负极连接,Co(NO3)2溶液作电解质,装置图为 ,
,
故答案为: ;
;
(2) ①Fe与电源正极连接、是活泼电极,Fe失去电子生成FeO42,电极方程式为Fe6e+8OH=FeO42+4H2O,反应的离子方程式为Fe+2H2O+2OH=FeO42+3H2↑,反应消耗OH,所以溶液的碱性减弱、PH减小,
故答案为:Fe6e+8OH=FeO42+4H2O;减小;
②防止生成的Na2FeO4被H2还原、降低Na2FeO4的产率,所以阴极产生的H2要及时排出;
故答案为:防止阴极产生的H2与阳极生成的Na2FeO4反应降低产率。

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案【题目】某化学研究性学习小组将高锰酸钾粉末与一定量铁粉混合隔绝空气加热,并在实验结束后对所得产物中不溶于水的黑色粉末X进行探究。
(探究目的)分析黑色粉末X的组成,并进行相关实验。
(猜想与假设)该黑色粉末可能含有铁粉、二氧化锰、四氧化三铁中的一种或几种。
(初步认证)将磁铁靠近黑色粉末,部分被吸引。
(初步结论)黑色粉末中_______含有MnO2,;_______含有Fe;________含有Fe3O4(填“一定”、“可能”或“一定不”)。
(定性检验)
实验步骤 | 实验操作 | 实验现象 |
步骤一 | 取少量黑色粉末于试管中,加足量稀硫酸,微热 | 黑色粉末部分溶解,无气泡产生 |
步骤二 | 将步骤一反应后试管中的物质过滤,向滤液中滴加几滴KSCN 溶液,振荡 | 溶液呈现红色 |
步骤三 | 取步骤二所得滤渣于试管中,加足量浓盐酸,加热 | 滤渣全部溶解,有黄绿色气体产生 |
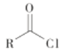
步骤三中产生气体的离子方程式为___________________________________________。
(定量检验)
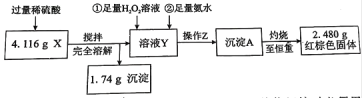
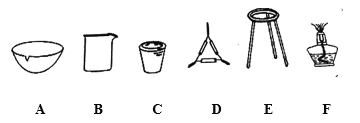
①操作Z的名称是__________,下图的仪器中,在灼烧沉淀时必须用到的是____________(填字母)。
②有同学认为:上述流程若不加入H2O2,其它步骤不变,只要在空气中充分放置仍可达到目的。他的理由是(用化学方程式表示)__________________________________________。
③通过以上数据,得出4.116 g黑色粉末X中各成分的物质的量为_________________。