题目内容
4. 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:(1)基态Ge原子的外围电子排布式为4s24p2,有2个未成对电子.
(2)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂.Zn、C、O电负性由大至小的顺序是O>C>Zn.
硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域.
(3)BF3中B原子的杂化类型为sp2,BF3分子空间构型为平面三角形.写出一种与BF3互为等电子体的离子的化学式:CO32-.
(4)在硼、氧、氟、氮中第一电离能由大到小的顺序是(用元素符号表示)F>N>O>B.
有机物丁二酮肟(
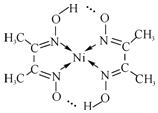
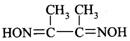 )常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示.
)常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示.(5)1mol丁二酮肟分子所含σ键的数目为15NA.
(6)在鲜红色沉淀中氮镍之间形成的共价键又称为配位键.
分析 (1)Ge是32号元素,位于第四周期第IVA族,基态Ge原子核外电子排布式为[Ar]3d104s24p2;
(2)元素的非金属性越强,吸引电子的能力越强,元素的电负性越大;
(3)根据中心原子的价层电子对数判断杂化类型和空间结构;具有相同的原子数和价电子数的微粒互为等电子体;
(4)同周期从左到右第一电离能呈递增趋势,但是第IIA与IIIA族、第VA与第VIA族反常;
(5)单键中含有一个σ键,双键中含有2个σ键;
(6)当共价键中共用电子对是由其中一原子独自供应,另一原子提供空轨道时,此共价键属于配位键.
解答 解:(1)Ge是32号元素,位于第四周期第IVA族,基态Ge原子核外电子排布式为1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2,在最外层的4s能级上2个电子为成对电子,4p轨道中2个电子分别处以不同的轨道内,有2轨道未成对电子,
故答案为:4s24p2;2;
(2)元素非金属性:Zn<C<O,元素的非金属性越强,吸引电子的能力越强,元素的电负性越大,故电负性:O>C>Zn,
故答案为:O>C>Zn;
(3)BF3中B原子价层电子对数=3+$\frac{1}{2}$(3-3×1)=3,杂化类型为sp2,B原子周围没有孤电子对,则BF3的空间构型为平面三角形;具有相同的原子数和价电子数的微粒互为等电子体,与互为等电子体的离子为 CO32-;
故答案为:sp2;平面三角形; CO32-;
(4)同周期从左到右第一电离能呈递增趋势,但是第IIA与IIIA族、第VA与第VIA族反常,所以硼、氧、氟、氮中第一电离能由大到小的顺序是:F>N>O>B;
故答案为:F>N>O>B;
(5)丁二酮肟(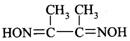 )分子中含有13个单键和2个双键,单键中含有一个σ键,双键中含有2个σ键,所以1mol该物质中含有σ键15NA个;
)分子中含有13个单键和2个双键,单键中含有一个σ键,双键中含有2个σ键,所以1mol该物质中含有σ键15NA个;
故答案为:σ键;15NA;
(6)当共价键中共用电子对是由其中一原子独自供应,另一原子提供空轨道时,此共价键属于配位键,图中氮镍之间形成的共价键属于配位键;
故答案为:配位键.
点评 本题考查了物质结构与性质,涉及核外电子排布、化学键、电负性、杂化方式、配位键等,题目难度中等,侧重于考查学生对基础知识的综合应用能力,注意把握杂化类型的判断方法.

| A. | c (NH3•H2O)>c (NH4+)>c (H+)>c (OH-) | B. | c (NH4+)>c (NH3•H2O)>c (OH-)>c (H+) | ||
| C. | c (NH3•H2O)>c (NH4+)=c (OH-)>c (H+) | D. | c (NH3•H2O)>c (OH-)>c (NH4+)>c (H+) |

下列有关信息错误的是( )
| A. | 图中新月形分子和环状分子“组合”在一起,铜离子起关键作用 | |
| B. | 利用此方式可以合成新分子,同时也可能创造一种全新“机械键” | |
| C. | 在创造新分子技术中,铜离子是唯一可以借助的金属离子 | |
| D. | 此技术可以“互锁”合成 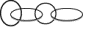 分子,甚至成更复杂的分子 分子,甚至成更复杂的分子 |
| A. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则该溶液中一定不含K+ | |
| B. | 向无色溶液中加入盐酸酸化的BaCl2溶液有白色沉淀出现,则该溶液中一定含有SO42- | |
| C. | 向无色溶液中加入盐酸产生能使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- | |
| D. | 向某溶液中加入KSCN溶液无现象,再滴入少量H2O2,呈血红色,则该溶液中一定含有Fe2+ |
| A. | 苯的三氯代物一共有 5 种 | |
| B. | 乙烯和乙酸均能发生加成反应 | |
| C. | 乙烷通入氯水中能发生取代反应 | |
| D. | 淀粉和纤维素都属于天然高分子化合物 |
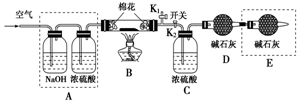 为探究所得的水合碱式碳酸镁[mMgCO3•nMg(OH)2•x
为探究所得的水合碱式碳酸镁[mMgCO3•nMg(OH)2•x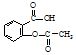 )具有解热镇痛作用(选填“解热镇痛”或“抗菌消炎”),必须密闭干燥存储以防止发生水解,在酸性条件下阿司匹林水解生成乙酸和
)具有解热镇痛作用(选填“解热镇痛”或“抗菌消炎”),必须密闭干燥存储以防止发生水解,在酸性条件下阿司匹林水解生成乙酸和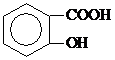 (写出结构简式).
(写出结构简式).