题目内容
13.回收的铜可用于制备胆矾(CuSO4•5H2O).将铜和一定浓度稀硫酸混合后在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2$\frac{\underline{\;高温\;}}{\;}$2CuSO4+2H2O.制得硫酸铜溶液后经过蒸发、浓缩、冷却结晶、过滤可得胆矾.
(1)请分析2Cu+2H2SO4+O2$\frac{\underline{\;高温\;}}{\;}$2CuSO4+2H2O反应中,氧化剂是O2,氧化产物是CuSO4(填化学式).
(2)用双线桥标出上述反应的电子得失
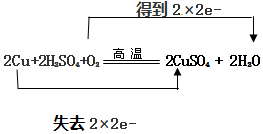 .
.(3)若有147gH2SO4参与反应,则转移的电子数目为3mol.
分析 (1)在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂生成氧化产物;
(2)反应中氧气为氧化剂,铜为还原剂,根据O元素的化合价0→-2,和Cu元素的化合价0→+2,标出电子的转移方向和数目;
(3)根据(2)2mol硫酸参加反应转移4moL电子计算.
解答 解:(1)2Cu+2H2SO4+O2$\frac{\underline{\;高温\;}}{\;}$2CuSO4+2H2O反应中,O2得电子化合价降低(0→-2)是氧化剂,Cu失电子化合价升高(0→+2)是还原剂,生成CuSO4为氧化产物
故答案为:O2;CuSO4;
(2)2Cu+2H2SO4+O2$\frac{\underline{\;高温\;}}{\;}$2CuSO4+2H2O反应中氧气为氧化剂,O元素的化合价0→-2,铜为还原剂,Cu元素的化合价0→+2,转移电子数为:4e-,用双线桥表示为: ,故答案为:
,故答案为: ;
;
(3)由(2)2mol硫酸参加反应转移4moL电子,所以若有147gH2SO4参与反应,则转移的电子数目为$\frac{147g}{98g/mol}$×2=3mol,故答案为:3mol.
点评 本题考查了氧化还原反应等知识,明确元素化合价是解本题关键,侧重对学生能力的培养和训练,有利于培养学生灵活运用知识解答问题的能力,题目难度中等.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
3.“农夫山泉”矿泉水瓶的标签上印有如下字样:Ca≥4.0mg/L Mg≥0.5mg/L K≥0.35mg/L Na≥0.8mg/L等,这里的Ca、Mg、K、Na是指( )
| A. | 物质 | B. | 分子 | C. | 原子 | D. | 离子 |
4.下列电离方程式书写正确的是( )
| A. | H2SO4→2H++SO42 | B. | Ba(OH)2→Ba2++(OH)2 | ||
| C. | FeCl3→Fe2++3Cl- | D. | NaHCO3→Na++H++CO32- |
18.能正确表示下列化学反应的离子方程式是( )
| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+═H2O | |
| B. | 将钠投入到硫酸铜溶液中发生的反应:2Na+Cu2+=2Na++Cu | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
5. 如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.
如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.
已知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O对实验现象的“解释或结论”正确的是( )
 如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.
如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.已知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O对实验现象的“解释或结论”正确的是( )
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | e处变红色 | 还原性:Fe2+>Cl- |
| D | d处立即褪色 | 氯气与水生成了漂白性物质 |
| A. | A | B. | B | C. | C | D. | D |
 置于光亮处
置于光亮处
 ) 可以通过不同的反应得到②~⑤四种物质.
) 可以通过不同的反应得到②~⑤四种物质.