题目内容
2.Na2CO3和KHCO3混合物与7.3%的盐酸450g恰好完全反应,放出标况下15.68L CO2,则混合物中含Na2CO3多少摩尔?分析 发生Na2CO3+2HCl=NaCl++CO2↑+H2O、KHCO3+HCl=KCl+CO2↑+H2O,n(HCl)=$\frac{450g×7.3%}{36.5g/mol}$=0.9mol,n(CO2)=$\frac{15.68L}{22.4L/mol}$=0.7mol,结合反应计算.
解答 解:n(HCl)=$\frac{450g×7.3%}{36.5g/mol}$=0.9mol,n(CO2)=$\frac{15.68L}{22.4L/mol}$=0.7mol,
设混合物含Na2CO3为xmol,KHCO3为ymol,则
$\left\{\begin{array}{l}{2x+y=0.9}\\{x+y=0.7}\end{array}\right.$
解得x=0.2mol,
答:混合物中含Na2CO3为0.2摩尔.
点评 本题考查混合物的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.

练习册系列答案
相关题目
10.下列判断反应自发性的描述正确的是( )
| A. | 焓减少的反应一定可以自发进行 | B. | 焓增加的反应可能自发进行 | ||
| C. | 熵增加的反应一定可以自发进行 | D. | 熵减少的反应一定不能自发进行 |
7.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 氯水的颜色呈黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向NaBr溶液中滴加氯水,溶液颜色变成黄色,说明氯水中含有HClO |
14.以下各分子中,所有原子都满足最外层为8电子结构的是( )
| A. | CO2 | B. | BF3 | C. | PCl5 | D. | H3O+ |
11.在一定温度下的恒容密闭容器中,发生可逆反应 2A(g)+B(g)?2C(g),下列叙述不能作为达到平衡的标志的是( )
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内2a mol A生成,同时生成a mol B | |
| C. | A、B、C的浓度不再变化 | |
| D. | 混合气体的总压强不再变化 |
12.人类社会的发展离不开科学家的贡献,下列说法中正确的是( )
| A. | 汤姆生--提出带核的原子结构模型 | |
| B. | 维勒--合成尿素实现了无机物向有机物的转化 | |
| C. | 玻尔--根据ɑ粒子散射现象提出原子结构的量子力学模型 | |
| D. | 侯德榜--侯氏制碱法的原理是将氨气通入二氧化碳的氯化钠饱和溶液中 |
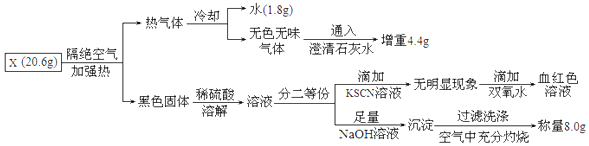
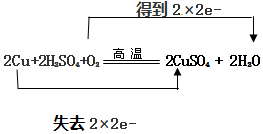 .
.