题目内容
5.下列烷烃的沸点:甲烷:-162℃;乙烷:-89℃;丁烷:-1℃;戊烷:36℃.根据以上数据推断丙烷的沸点可能是( )| A. | 约-40℃ | B. | 低于-162℃ | C. | 低于-89℃ | D. | 高于36℃ |
分析 由题干烷烃沸点数据可以看出,烷烃中碳原子个数越多,沸点越大,则丙烷的沸点应该在乙烷和丁烷之间,据此进行解答.
解答 解:根据题干烷烃沸点数据可以看出,烷烃中烷烃的熔沸点随着C原子个数增大而升高,丙烷中C原子个数大于乙烷而小于丁烷,所以丙烷的沸点应该在乙烷和丁烷之间,即大于-89℃小于-1℃,
故选A.
点评 本题考查烷烃中熔沸点大小比较,题目难度不大,试题侧重考查学生分析、总结能力,明确C原子个数与熔沸点的关系即可解答,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.以下叙述中错误的是( )
| A. | 反应物的总能量低于生成物的总能量时,则反应释放能量 | |
| B. | 物质燃烧可看做“储存”在物质内部的能量(化学能)转化为热能释放出来 | |
| C. | 钠原子与氯原子结合生成氯化钠后,其结构的稳定性增强,体系的能量降低 | |
| D. | 当断开旧键吸收的能量大于形成新键放出的能量时,该反应为吸收能量的反应 |
13.下列实验能获得成功的是( )
| A. | 苯与浓溴水反应制取溴苯 | |
| B. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| C. | 1 mol•L-1 CuSO4溶液2mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 | |
| D. | 向稀苯酚中加浓溴水观察沉淀 |
20.下列实验中能证明某气体为SO2的是( )
①使澄清石灰水变浑浊
②使湿润的蓝色石蕊试纸变红
③使品红溶液褪色
④通入足量NaOH溶液中,再滴加BaC12溶液,有白色沉淀生成,该沉淀溶于稀盐酸.
①使澄清石灰水变浑浊
②使湿润的蓝色石蕊试纸变红
③使品红溶液褪色
④通入足量NaOH溶液中,再滴加BaC12溶液,有白色沉淀生成,该沉淀溶于稀盐酸.
| A. | 只有④能证明 | B. | 都不能证明 | C. | ③④均能证明 | D. | 都能证明 |
10.在冶金工业中,常用电解法得到钠、镁、铝等金属,其原因是( )
| A. | 都是轻金属 | B. | 都是活泼金属 | ||
| C. | 成本低廉 | D. | 这些金属的化合物熔点较低 |
17.下列关于Fe(NO3)3溶液的叙述正确的是( )
| A. | 该溶液中,Na+、H+、Cl-、Mg2+可以大量共存 | |
| B. | 与KSCN溶液反应产生红色沉淀 | |
| C. | 加入铜粉,反应的离子方程式为:Cu+Fe3+=Cu2++Fe2+ | |
| D. | 向该溶液中滴入少量Na2S溶液,反应的离子方程式为:2Fe3++3S2-+6H2O=3H2S↑+2Fe(OH)3↓ |
14.由水钴矿[主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等]制取CoCl2•6H2O的工艺流程如下:
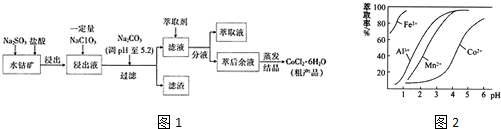
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等.
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表.
③CoCl2•6H2O熔点为86℃,加热至110-120℃时,失去结晶水生成CoCl2.
回答下列问题:
(1)浸出过程中Co2O3发生反应的化学方程式为Co2O3+Na2SO3+4HCl=2CoCl2+Na2SO4+2H2O
(2)NaClO3在浸出液中发生反应的离子方程式为ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
(3)“加Na2CO3调pH至5.2”,过滤所得滤渣的主要成分为Fe(OH)3、Al(OH)3(填化学式).
(4)萃取剂对金属离子的萃取与溶液pH的关系如图2所示,向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+,其使用的最佳pH范围是B(填选项字母)
A.2.0-2.5 B.3.0-3.5C.4.0-4.5 D.5.0-5.5
(5)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.为测定粗产品中CoCl2•6H2O含量.称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是(写两条):①粗产品含有可溶性氯化物,②晶体失去了部分结晶水.

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等.
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)浸出过程中Co2O3发生反应的化学方程式为Co2O3+Na2SO3+4HCl=2CoCl2+Na2SO4+2H2O
(2)NaClO3在浸出液中发生反应的离子方程式为ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
(3)“加Na2CO3调pH至5.2”,过滤所得滤渣的主要成分为Fe(OH)3、Al(OH)3(填化学式).
(4)萃取剂对金属离子的萃取与溶液pH的关系如图2所示,向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+,其使用的最佳pH范围是B(填选项字母)
A.2.0-2.5 B.3.0-3.5C.4.0-4.5 D.5.0-5.5
(5)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.为测定粗产品中CoCl2•6H2O含量.称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是(写两条):①粗产品含有可溶性氯化物,②晶体失去了部分结晶水.
15.常温下,下列溶液中呈酸性的是( )
| A. | pH=2的溶液 | B. | c(H+)=1×10-7mol/L的溶液 | ||
| C. | c(OH-)=1×10-5mol/L的溶液 | D. | pH=9的溶液 |
 ,写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑;
,写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑;