题目内容
15.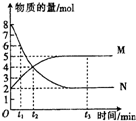 一定温度下,在容积为1L的密闭容器中进行反应:aN(g)?bM(g)△H<0,M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为1L的密闭容器中进行反应:aN(g)?bM(g)△H<0,M、N的物质的量随时间的变化曲线如图所示:(1)此反应的化学方程式中$\frac{a}{b}$=2.
(2)从t1到t2时刻,以M的浓度变化表示的平均反应速率为$\frac{2}{({t}_{2}-{t}_{1})}$mol/(L.min).t2时两线的交叉点不是(填“是”或“不是”)平衡状态,此时v正>v逆.(填“>”、“<”或“=”)
分析 (1)化学计量数之比等于反应速率之比,也等于物质的量的变化量之比;
(2)结合v=$\frac{△c}{△t}$计算速率,t2时物质的量还在变化,仍为正反应阶段.
解答 解:(1)化学计量数之比等于反应速率之比,也等于物质的量的变化量之比,由0~t2时物质的量变化可知,则此反应的化学方程式中$\frac{a}{b}$=$\frac{8-4}{4-2}$=2,故答案为:2;
(2)从t1到t2时刻,以M的浓度变化表示的平均反应速率为v=$\frac{△c}{△t}$=$\frac{\frac{4mol-2mol}{1L}}{{(t}_{2}-{t}_{1})min}$=$\frac{2}{({t}_{2}-{t}_{1})}$mol/(L.min),t2时物质的量还在变化,仍为正反应阶段,则t2时两线的交叉点不是平衡状态,此时v正>v逆,
故答案为:$\frac{2}{({t}_{2}-{t}_{1})}$mol/(L.min);不是;>.
点评 本题考查物质的量随时间的变化曲线及应用,为高频考点,把握速率的计算及平衡的判断为解答的关键,注意物质的量不变时达到平衡状态,题目难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
5.下列各组离子能大量共存的是( )
| A. | “84”消毒液的水溶液中:Fe2+、Cl-、H+、Na+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、S2- | |
| C. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- | |
| D. | pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ |
6.下列依据热化学方程式得出的结论正确的是( )
| 热化学方程式 | 结 论 | |
| A. | 2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol | 氢气的燃烧热△H=-483.6 kJ/mol |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=-57.3 kJ/mol | 含40.0g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ |
| C. | 2C(s)+2O2(g)═2CO2(g)△H=-a kJ/mol 2C(s)+O2(g)═2CO(g)△H=-b kJ/mol | b>a |
| D. | C (石墨,s)═C (金刚石,s)△H=+1.5 kJ/mol | 金刚石比石墨稳定 |
| A. | A | B. | B | C. | C | D. | D |
20.空气的成分中,体积分数约为78%的是( )
| A. | 氮气 | B. | 氧气 | C. | 水蒸气 | D. | 二氧化碳 |
7.出土的古文物中,金器保存完好,铜器表面有锈迹,而铁器锈蚀严重.这表明金、铜、铁的金属活动性从强到弱的顺序是( )
| A. | 金、铜、铁 | B. | 铁、铜、金 | C. | 铁、金、铜 | D. | 铜、金、铁 |
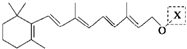
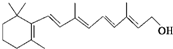 )和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
)和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.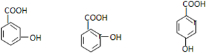 .
.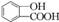 .
.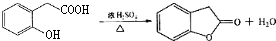 .
. .
.