题目内容
浓硫酸和铜在加热时反应,生成二氧化硫气体的体积为3.36L(标准状况下)。已知:
Cu+2H2SO4(浓) 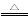 CuSO4+SO2↑+2H2O。试计算:
CuSO4+SO2↑+2H2O。试计算:
(1)反应中消耗的铜的质量;
(2)将生成的硫酸铜配制成500mL溶液,则该溶液中CuSO4的物质的量浓度是多少?
(1)9.6g (2)0.3mol/L
【解析】
试题分析:假设消耗铜的质量为m克,则根据方程式列式计算:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
1 22.4
m n 3.36
64/m=22.4/3.36 m=9.6g
1/n=22.4/3.36 n=0.15mol
硫酸铜的浓度=0.15/0.5=0.3mol/L。
考点:化学方程式的计算,物质的量浓度。

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目

 ?C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2 mol/L;途径Ⅱ:C、D的起始浓度分别为2 mol/L和6 mol/L,则以下叙述正确的是
?C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2 mol/L;途径Ⅱ:C、D的起始浓度分别为2 mol/L和6 mol/L,则以下叙述正确的是
 H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是 。它的一氯代物有 种。
。它的一氯代物有 种。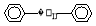 ,试再写出另一种的结构简式____________。
,试再写出另一种的结构简式____________。