题目内容
14.用NA表示阿伏加德罗常数的值,下列说法错误的是( )| A. | 20℃时,铝的密度为2.7 g/cm3,则1个Al原子的体积为($\frac{10}{{N}_{A}}$)cm3 | |
| B. | 25℃、101KPa下,16 g O2与O3的混合气体中含电子数为8NA | |
| C. | 25℃、101KPa下,11.2L Cl2含有的分子数小于0.5NA | |
| D. | 0℃、101KPa下,等体积的CH4和CCl4中含C原子数相等 |
分析 A、求出1mol铝的质量和体积,然后根据1mol铝中含NA个铝原子来分析;
B、氧气和臭氧均由氧原子构成;
C、25℃、101KPa下,气体摩尔体积大于22.4L/mol;
D、0℃、101KPa下,四氯化碳为液体.
解答 解:A、1mol铝即NA个铝原子的质量为27g,体积为$\frac{27g}{2.7g/mL}$,则1个Al原子的体积为$\frac{10}{{N}_{A}}$cm3,故A正确;
B、氧气和臭氧均由氧原子构成,故16g氧气和臭氧的混合物中含有的氧原子的物质的量为1mol,而1mol氧原子的核外有8mol电子,故含8NA个电子,故B正确;
C、25℃、101KPa下,气体摩尔体积大于22.4L/mol,故11.2L氯气的物质的量小于0.5mol,则分子个数小于0.5NA个,故C正确;
D、0℃、101KPa下,四氯化碳为液体,而甲烷为液体,故两者的物质的量不同,则含有的碳原子个数不同,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.化学与生产、生活、科技等密切相关,下列说法正确的是( )
| A. | 石油裂解的目的是提高汽油等轻质油的产量和质量 | |
| B. | “神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 | |
| C. | 补血口服液中添加维生素c,作为氧化剂 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 |
2.化学对推动人类进步、提高生活质量作出了不可磨灭的贡献.下列物质的名称、化学式、用途中不正确的是( )
| A. | 石膏:CaSO4•2H2O,可用于制造各种模型 | |
| B. | 重晶石:BaCO3,可作白色颜料、医疗上“钡餐” | |
| C. | 绿矾:FeSO4•7H2O,可生产净水剂、防止缺铁性贫血的药剂 | |
| D. | 胆矾:CuSO4•5H2O,可用于生产农药 |
19.下列溶液中,离子一定能大量共存的是( )
| A. | pH=1的溶液中:K+ CH3COO- SO42- Na+ | |
| B. | 含有0.1mol/LCa2+的溶液中:Na+SO42- K+ Cl- | |
| C. | 含有0.1mol/LMg2+的溶液中:Na+SO42- K+ HCO3- | |
| D. | 滴入酚酞显红色的溶液:K+ HCO3-Ba2+Cl- |
6.1000ml某无色待测液中除含有0.2mol•L-1的Na+外,还可能含有下列离子中的一种或多种:
现进行如下实验操作(所加试剂均过量):(已知:NH4++OH-(浓)=NH3↑+H2O)
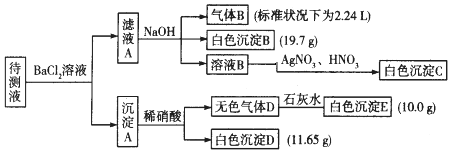
(1)原溶液中肯定存在的离子是(除Na+)CO32-、HCO3-、SO42-、K+、NH4+,肯定不存在的离子是Fe3+、Ba2+.
(2)写出生成白色沉淀B的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O.写出沉淀A溶于稀硝酸的离子方程式:BaCO3+2H+=Ba2++H2O+CO2↑.
(3)将滤液A和沉淀A分开的操作是过滤,洗涤.洗涤的操作是沿玻璃棒继续向漏斗中加水至刚好浸没沉淀,待水自然流下后重复操作2-3次.
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、CO32-、HCO3-、SO42- |

(1)原溶液中肯定存在的离子是(除Na+)CO32-、HCO3-、SO42-、K+、NH4+,肯定不存在的离子是Fe3+、Ba2+.
(2)写出生成白色沉淀B的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O.写出沉淀A溶于稀硝酸的离子方程式:BaCO3+2H+=Ba2++H2O+CO2↑.
(3)将滤液A和沉淀A分开的操作是过滤,洗涤.洗涤的操作是沿玻璃棒继续向漏斗中加水至刚好浸没沉淀,待水自然流下后重复操作2-3次.
3.以下转化不能一步反应实现的是( )
| A. | Al2O3-->Al(OH)3 | B. | Cu-->CuCl2 | C. | Fe-->FeCl2 | D. | Na-->NaOH |
 氰、硫、碳的氧化物有多种,其中S02和N0x都是大气污染物,对它们的研究有助于空气的净化.
氰、硫、碳的氧化物有多种,其中S02和N0x都是大气污染物,对它们的研究有助于空气的净化.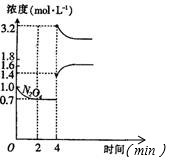

 .
. .
.