题目内容
下列各组物质中,所含分子数相同的是( )
| A、10gH2 和 10g O2 |
| B、11.2L N2 (标准状况) 和 11g CO2的分子数 |
| C、9g H2O 和0.5mol Br2 |
| D、224ml H2 (标准状况) 和0.1 mol N2 |
考点:物质的量的相关计算
专题:阿伏加德罗常数和阿伏加德罗定律
分析:根据N=nNA可知,物质的量越大,含有分子数目越大,含有分子数目相等,则分子物质的量相等.
A.根据n=
判断氢气和氧气的物质的量;
B.根据n=
计算氮气的物质的量,根据n=
计算二氧化碳的物质的量;
C.根据n=
计算水的物质的量;
D.根据n=
计算氢气的物质的量.
A.根据n=
| m |
| M |
B.根据n=
| V |
| Vm |
| m |
| M |
C.根据n=
| m |
| M |
D.根据n=
| V |
| Vm |
解答:
解:A.根据n=
可知,相同质量的氢气、氧气,由于氢气的摩尔质量较小,故氢气的物质的量较大,含有分子数目较多,故A错误;
B.标况下11.2L N2物质的量是0.5mol,11g二氧化碳的物质的量为
=0.25mol,二者物质的量不相等,含有分子数目不相等,故B错误;
C.9gH2O物质的量为
=0.5mol,和0.5mol Br2的物质的量相同,而含有分子数相同,故C正确;
D.标况下224mL氢气的物质的量为
=0.01mol,和0.1 mol N2含有的分子数目不相同,故D错误,
故选C.
| m |
| M |
B.标况下11.2L N2物质的量是0.5mol,11g二氧化碳的物质的量为
| 11g |
| 44g/mol |
C.9gH2O物质的量为
| 9g |
| 18g/mol |
D.标况下224mL氢气的物质的量为
| 0.224L |
| 22.4L/mol |
故选C.
点评:本题考查物质的量有关计算,侧重考查微粒数目的计算,题目较简单,有利于基础知识的巩固.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
| A、增加压强 |
| B、降低温度 |
| C、增大CO的浓度 |
| D、更换催化剂 |
某元素的一个原子形成的离子可表示为
Xn-,下列说法正确的是( )
b a |
A、
| ||
B、
| ||
C、X原子的质量数为
| ||
D、X原子的质量约为
|
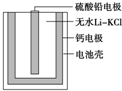 如图为一种热激活电池的基本结构,该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.作为电解质的无水LiClKCl混合物受热熔融后,电池即可瞬间输出电能.下列有关说法正确的是( )
如图为一种热激活电池的基本结构,该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.作为电解质的无水LiClKCl混合物受热熔融后,电池即可瞬间输出电能.下列有关说法正确的是( )| A、正极反应式:Ca+2Cl-+2e-═CaCl2 |
| B、放电过程中,Li+向负极移动 |
| C、每转移0.1mol电子,理论上生成20.7gPb |
| D、常温时,在正负极间接上电流表或检流计,指针不偏转 |
与6.4g SO2所含的氧原子数相等的NO2的质量是( )
| A、3.2g | B、4.6g |
| C、6.4g | D、2.3g |
下列叙述正确的是( )
| A、氯气溶于水形成的溶液能导电,故氯气是电解质 |
| B、没有氧元素参加的反应一定不是氧化还原反应 |
| C、在水中能电离出H+的化合物一定是酸 |
| D、有单质生成的分解反应一定是氧化还原反应 |
1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol?l-1和0.4mol?l-1.若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
| A、2.4g | B、3.2g |
| C、6.4g | D、9.6g |
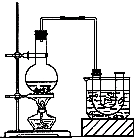 已知:CH3CH2OH+NaBr+H2SO4(浓)
已知:CH3CH2OH+NaBr+H2SO4(浓)