题目内容
7.对于合成氨3H2(g)+N2(g)?2NH3(g)△H<0,下列事实不能用勒夏特列原理解释的是( )| A. | 温度过高对合成氨不利 | |
| B. | 合成氨在高压下进行是有利的 | |
| C. | 高温及加入催化剂都能使合成氨的反应速率加快 | |
| D. | 增加N2的浓度可提高平衡混合物中NH3的含量 |
分析 勒夏特列原理是:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.勒夏特列原理适用的对象应存在可逆过程,若与可逆过程无关,与平衡移动无关,则不能用勒夏特列原理解释.
解答 解:A.该反应的正逆反应是放热反应,温度越高,平衡逆向移动,对合成氨不利,所以可以用平衡移动原理解释,故A不选;
B.该反应前后气体的物质的量之和减小,增大压强,平衡正向移动,所以合成氨在高压下进行是有利的,可以用平衡移动原理解释,故B不选;
C.催化剂能增大化学反应速率,但不引起平衡移动,所以不能用平衡移动原理解释,故C选;
D.增加氮气浓度,平衡正向移动,所以可以提高平衡混合物中氨气含量,所以可以用平衡移动原理解释,故D不选;
故选C.
点评 本题考查化学平衡移动原理,为高频考点,只有能引起平衡移动的因素才能用勒夏特里原理解释,注意:催化剂只改变化学反应速率不影响平衡移动.

练习册系列答案
相关题目
17.草酸是二元弱酸,测得0.01mol•L-1草酸氢钠溶液显酸性.常温下向10mL 0.01mol•L-1 NaHC2O4溶液中滴加0.01mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,下列说法正确的是( )
| A. | V(NaOH)=0时,c(Na+)>c(H+)>c(HC2O4- )>c(C2O42-)>c(OH-) | |
| B. | V(NaOH)=5 mL时,c(Na+)═c(C2O42-)+c(HC2O4- )+c(H2C2O4) | |
| C. | V(NaOH)=10 mL时,c(Na+)═c(HC2O4-)+c(C2O42-) | |
| D. | V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- ) |
2.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,物质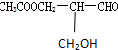 有光学活性,此分子中手性碳原子数目( )
有光学活性,此分子中手性碳原子数目( )
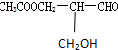 有光学活性,此分子中手性碳原子数目( )
有光学活性,此分子中手性碳原子数目( )| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
19.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是614C;
(2)实验室检验Y元素的气态氢化物的方法和现象是用湿润的红色石蕊试纸检验,试纸变蓝;
(3)Z元素与氢元素、氧元素形成的化合物HZO有漂白性,其结构式为H-O-Cl;
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填分子式),理由是H2CO3是弱酸,其余均为强酸;
(5)将T元素的氧化物TO2和Z的单质同时通入水中,可发生反应,该反应化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4.
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的$\frac{3}{8}$ |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)实验室检验Y元素的气态氢化物的方法和现象是用湿润的红色石蕊试纸检验,试纸变蓝;
(3)Z元素与氢元素、氧元素形成的化合物HZO有漂白性,其结构式为H-O-Cl;
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填分子式),理由是H2CO3是弱酸,其余均为强酸;
(5)将T元素的氧化物TO2和Z的单质同时通入水中,可发生反应,该反应化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4.
17.某有机物在氧气中充分燃烧,生成的二氧化碳和水的物质的量之比为1:1,由此可得出的正确结论是( )
| A. | 该有机物分子中碳、氢、氧原子个数比为1:2:3 | |
| B. | 该有机物分子中碳、氢原子个数比为1:2 | |
| C. | 该有机物中肯定含氧 | |
| D. | 可以判断该有机物中是否含氧 |


 ;
; .
.