题目内容
10.区分晶体和非晶体最可靠的科学方法是( )| A. | 观察外观是否规则 | B. | 测定是否有固定的熔点 | ||
| C. | 验证是否有各向异性 | D. | 进行X射线衍射实验 |
分析 构成晶体的粒子在微观空间里呈现周期性的有序排列,晶体的这一结构特征可以通过X-射线衍射图谱反映出来.因此,区分晶体和非晶体的最可靠的科学方法是对固体进行X-射线衍射实验,以此来解答.
解答 解:晶体与非晶体最本质的区别是组成物质的粒子在微观空间是否有序排列,x射线衍射可以看到微观结构,而有些晶体的熔沸点较低,硬度较小,如Na等金属晶体,有些晶体不能导电,所以不能通过测固体的熔点、看外观是否规则、是否有各向异性来判断,
故选D.
点评 本题考查的是晶体和非晶体的区别,难度不大,注意晶体与非晶体最本质的区别是组成物质的粒子在微观空间是否有序排列.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20. 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,请根据要求回答下列问题:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有:增大乙醇浓度、移去生成物等.
(2)若用如图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为原料来不及反应就被蒸出、温度过高发生副反应等.
(3)此反应以浓硫酸为催化剂,可能会造成产生大量酸性废液污染环境、部分原料炭化等问题.
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用.实验数据如下表所示(乙酸和乙醇以等物质的量混合).
①根据表中数据,下列C (填字母)为该反应的最佳条件.
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
②当反应温度达到120℃时,反应选择性降低的原因可能为乙醇脱水生成乙醚.
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,请根据要求回答下列问题:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,请根据要求回答下列问题:(1)欲提高乙酸的转化率,可采取的措施有:增大乙醇浓度、移去生成物等.
(2)若用如图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为原料来不及反应就被蒸出、温度过高发生副反应等.
(3)此反应以浓硫酸为催化剂,可能会造成产生大量酸性废液污染环境、部分原料炭化等问题.
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用.实验数据如下表所示(乙酸和乙醇以等物质的量混合).
| 同一反应时间 | 同一反应温度 | |||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* | |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 | |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 | |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 | |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 | |
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
②当反应温度达到120℃时,反应选择性降低的原因可能为乙醇脱水生成乙醚.
1.下列物质的名称、俗名与化学式完全对应的是( )
| A. | 氯化钠 食盐 NaCl2 | B. | 碳酸氢钠 纯碱 NaHCO3 | ||
| C. | 氢氧化钠 烧碱 NaOH | D. | 氢氧化钙 熟石灰 CaO |
18.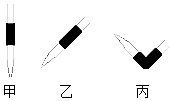 某学生用0.4000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.4000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)用标准溶液润洗滴定管2-3次
(B)取标准NaOH溶液注入碱式滴定管至0刻度以上2-3cm
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)调节液面至0或0刻度以下,记下读数
(E)移取10.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(F)在锥形瓶下垫一张白纸,用标准NaOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)排去碱式滴定管中气泡的方法应采用如图的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(2)E操作中在锥形瓶下垫一张白纸的作用是便于准确判断终点时颜色的变化情况
(3)实验中,用左手控制活塞(填仪器及名称),眼睛应注视锥形瓶内溶液颜色的变化,直至滴定终点.
(4)几次滴定消耗NaOH溶液的体积如表:
则该盐酸溶液的准确浓度为0.8000mol/L.(保留小数点后4位)
(5)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是:CD (错选全扣)
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
E.碱式滴定管滴定前无气泡,滴定后尖嘴部分有气泡.
 某学生用0.4000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.4000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:(A)用标准溶液润洗滴定管2-3次
(B)取标准NaOH溶液注入碱式滴定管至0刻度以上2-3cm
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)调节液面至0或0刻度以下,记下读数
(E)移取10.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(F)在锥形瓶下垫一张白纸,用标准NaOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)排去碱式滴定管中气泡的方法应采用如图的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(2)E操作中在锥形瓶下垫一张白纸的作用是便于准确判断终点时颜色的变化情况
(3)实验中,用左手控制活塞(填仪器及名称),眼睛应注视锥形瓶内溶液颜色的变化,直至滴定终点.
(4)几次滴定消耗NaOH溶液的体积如表:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
(5)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是:CD (错选全扣)
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
E.碱式滴定管滴定前无气泡,滴定后尖嘴部分有气泡.
15.化学源于生活又用于生活,下列有关应用不正确的是( )
| A. | 用浸泡高锰酸钾溶液的硅土来吸收水果或花朵产生的乙烯以达到保鲜效果 | |
| B. | 淀粉、油脂、蛋白质都是天然高分子化合物 | |
| C. | 加热能杀死流感病毒是因为病毒的蛋白质受热变性 | |
| D. | 含硫化石燃料的大量燃烧是酸雨形成的主要原因之一 |
2.某些含羟基的药物具有苦味,如以下结构的氯霉素: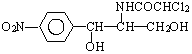 .此药物分子中碳链末端羟基(-OH)中的氢原子换成来自棕榈酸中的原子团
.此药物分子中碳链末端羟基(-OH)中的氢原子换成来自棕榈酸中的原子团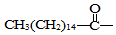 后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
 .此药物分子中碳链末端羟基(-OH)中的氢原子换成来自棕榈酸中的原子团
.此药物分子中碳链末端羟基(-OH)中的氢原子换成来自棕榈酸中的原子团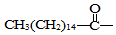 后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )| A. | 它是棕榈酸的盐类 | B. | 它不是棕榈酸的酯类 | ||
| C. | 它的水溶性变差,所以苦味消失 | D. | 它的水溶性变良,所以苦味消失 |
19.等质量的CO和N2,下列叙述不正确的是( )
| A. | 密度一定相同 | B. | 分子数一定相同 | ||
| C. | 原子数一定相同 | D. | 物质的量一定相同 |
20.现有NH4Cl、MgSO4、(NH4)2SO4和NaCl四种无色溶液,用一种试剂就可将它们鉴别出来,这种试剂是( )
| A. | NaOH | B. | Ba(OH)2 | C. | AgNO3 | D. | HCl |