题目内容
13.某化工厂的废水中含1%的H2SO4,采用边排放边处理成化肥硫铵的方法变废为宝(如图所示).若处理后废水中的硫酸恰好全部转化为硫铵,则所用的20%氨水的流量为( )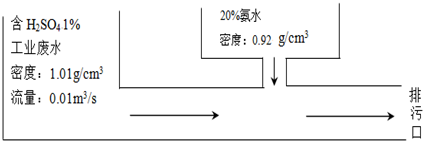
| A. | 1.98×10-3m3/s | B. | 5.49×10-4m3/s | C. | 1.90×10-4 m3/s | D. | 9.52×10-5 m3/s |
分析 根据图示可知,1s内通过的硫酸的量,通过硫酸与氨气反应的方程式可以推出消耗氨水的质量,进而可以推出氨水的流量.
解答 解:ρ=1.01g/cm3=1010g/m3
m(H2SO4)=ρVt×1%=1010g/m3×0.01m3/s×1s×1%=0.101g
n(H2SO4)=$\frac{m({H}_{2}S{O}_{4})}{M({H}_{2}S{O}_{4})}$=$\frac{0.101g}{98g/mol}$
H2SO4+2NH3=(NH4)2SO4
1 2
$\frac{0.101g}{98g/mol}$n(NH3)
n(NH3)=$\frac{0.101g}{98g/mol}$×2
m(NH3)=n(NH3)×M(NH3)=$\frac{0.101g}{98g/mol}$×2×17g/mol=0.035g
氨水的流量=$\frac{0.035g}{0.92g/c{m}^{3}×20%}$=0.19g/cm3;
故选C.
点评 本题难度不大根据方程式就可以进行计算,关键注意数据单位换算处理,属于基础题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列表示物质结构的化学用语正确的是( )
| A. | 8个中子的碳原子的核素符号:12C | B. | 氮气的电子式: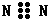 | ||
| C. | Cl-离子的结构示意图: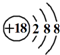 | D. | NaCl的电子式: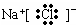 |
18.下列化学用语中,不正确的是( )
| A. | CO2的电子式: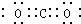 | B. | 乙炔分子的结构式H-C≡C-H | ||
| C. | H2O分子的比例模型  | D. | Clˉ离子的结构示意图: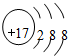 |
5.分类法是一种行之有效、简单易行的科学方法.某同学用下表所示形式对所学知识进行分类,其中甲与乙关系正确的是( )
| 选项 | 甲 | 乙 |
| A | 电解质 | BaSO4、NaHSO4、SO3 |
| B | 弱电解质的电离 | 均分步电离 |
| C | 化学平衡影响因素 | 温度、压强、浓度、催化剂等 |
| D | 化学电源 | 一次电池、二次电池、燃料电池等 |
| A. | A | B. | B | C. | C | D. | D |
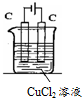 电解氯化铜溶液的化学方程式为CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑.电解过程中,Cu2+离子向阴极移动;Cl-在阳极失电子,发生氧化反应(填“氧化”或“还原”).电解过程中,如果有0.4mol的电子发生转移,理论上阴极的质量将增加12.8g.
电解氯化铜溶液的化学方程式为CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑.电解过程中,Cu2+离子向阴极移动;Cl-在阳极失电子,发生氧化反应(填“氧化”或“还原”).电解过程中,如果有0.4mol的电子发生转移,理论上阴极的质量将增加12.8g.