题目内容
8.20mL AB2气体与10mL B2气体,充分反应后生成了20mL X气体,以上气体均在相同条件下测定,则X的分子式可表示为什么?分析 相同条件下,气体摩尔体积相等,同一反应的各物质体积之比等于其计量数之比,再结合原子守恒判断X的分子式.
解答 解:相同条件下,气体摩尔体积相等,同一反应的各物质体积之比等于其计量数之比,所以AB2、B2、X的计量数之比=20mL:10mL:20mL=2:1:2,该反应方程式为2AB2+B2=2X,
根据原子守恒知,X的分子式为AB3,
答:X的分子式可表示为AB3.
点评 本题考查阿伏伽德罗定律及推论,明确相同条件下气体体积与化学计量数的关系是解本题关键,并结合质量守恒定律判断即可,题目难度不大,试题培养了学生的灵活应用能力.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
18.能大量共存于同一溶液中的离子组是( )
| A. | Ba2+、K+、Cl-、CO32- | B. | Na+、HCO3-、K+、OH- | ||
| C. | K+、Ag+、Cl-、NO3- | D. | Na+、SO42-、K+、OH- |
13.某化工厂的废水中含1%的H2SO4,采用边排放边处理成化肥硫铵的方法变废为宝(如图所示).若处理后废水中的硫酸恰好全部转化为硫铵,则所用的20%氨水的流量为( )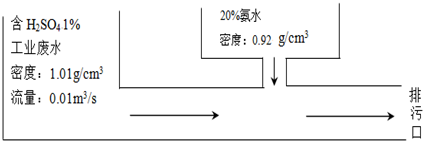

| A. | 1.98×10-3m3/s | B. | 5.49×10-4m3/s | C. | 1.90×10-4 m3/s | D. | 9.52×10-5 m3/s |
20.用NA表示阿伏加德罗常数,N表示微粒数,下列说法正确的是( )
| A. | 7.8 g苯含有碳碳双键的数目为0.3NA | |
| B. | 标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.3NA | |
| C. | 273K、101kPa下,28 g乙烯与丙烯混合物中含有C-H键的数目为5NA | |
| D. | 100 mL1mol•L-1的NaF中:N(F-)+N(HF)=0.1 NA |
17.在甲、乙两烧杯中,分别含有下列离子Cu2+、K+、H+、Cl-、CO32-、OH-中的三种离子.已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是( )
| A. | Cu2+、H+、Cl- | B. | CO32-、OH-、Cl- | C. | K+、H+、Cl- | D. | K+、CO32-、OH- |
15.由两种有机物组成的混合物,在一定的温度和压强下完全气化为气体,在相同的温度和压强下,只要混合气体体积一定,那么无论混合物以何种比例混合,它在完全燃烧时所消耗的氧气体积也是一定的,符合这种情况的可能是( )
| A. | 乙醇(C2H6O)和乙酸(C2H4O2) | B. | 乙醛(C2H4O)和甲醇(CH4O) | ||
| C. | 丙醛(C3H6O)和甘油(C3H8O3) | D. | 丙酮(C3H6O)和丙二醇(C3H8O2) |
 对于如图所示的有机化合物的说法,正确的有①②③④⑦.
对于如图所示的有机化合物的说法,正确的有①②③④⑦.