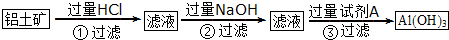题目内容
18.pH=11的NaOH溶液与pH=3CH3COOH的溶液等体积混合,下列关系正确的是( )| A. | c(Na+)=c(CH3COO-)+c(CH3COOH) | B. | c(H+)=c(CH3COO-)+c(OH-) | ||
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | D. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
分析 pH=11的NaOH溶液与pH=3CH3COOH的溶液等体积混合,得到的是醋酸和醋酸钠的混合物,溶液显示酸性,据此回答判断.
解答 解:pH=11的NaOH溶液与pH=3CH3COOH的溶液等体积混合,得到的是醋酸和醋酸钠的混合物,溶液显示酸性.
A、醋酸和醋酸钠的混合物中,c(Na+)<c(CH3COO-)+c(CH3COOH),故A错误;
B、存在电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故B错误;
C、醋酸和醋酸钠的混合物,溶液显示酸性,c(OH-)<c(H+),故C错误;
D、醋酸和醋酸钠的混合物,溶液显示酸性,c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D正确.
故选D.
点评 本题以酸碱混合溶液定性判断为载体考查离子浓度大小比较,侧重考查分析能力,熟练运用守恒思想解答问题,题目难度中等.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
8.下列化学用语书写正确的是( )
| A. | 醋酸与NaOH溶液反应的离子方程式为:H++OH-═H2O | |
| B. | 金属钠与乙醇反应的化学方程式为:2Na+2CH3CH2OH→2CH3CH2ONa+H2↑ | |
| C. | 聚氯乙烯的结构简式为: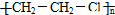 | |
| D. | 氯化铵的电子式为: |
9.下表为元素周期表的一部分.
回答下列问题:
(1)Z元素在周期表中的位置为第三周期,第ⅤⅡA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为 .Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
.Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
(5)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程
式Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50.为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/LNaOH溶液和1molO2,则两种气体的分子式及物质的量分别为NO 0.9mol,NO2 1.3mol,生成硫酸铜物质的量为2mol.
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期,第ⅤⅡA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为
 .Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
.Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.(5)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程
式Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50.为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/LNaOH溶液和1molO2,则两种气体的分子式及物质的量分别为NO 0.9mol,NO2 1.3mol,生成硫酸铜物质的量为2mol.
3.下列说法正确的是( )
| A. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成与氮的氧化物无关 | |
| B. | 钙、铁、碘都是人体内必需的微量元素 | |
| C. | 白酒中混有少量塑化剂,可通过过滤除去 | |
| D. | 登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性 |
10.短周期主族元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为24.X的原子半径比Y大,Y与Z同主族,Y原子的最外层电子数是电子层数的3倍,下列说法正确的是( )
| A. | Y元素形成的单核阴离子还原性强于X元素形成的单核阴离子还原性 | |
| B. | Z元素的简单气态氢化物的沸点比Y的氢化物沸点高 | |
| C. | W元素氧化物对应水化物的酸性一定强于Z元素氧化物对应水化物的酸性 | |
| D. | X的气态氢化物可与其最高价含氧酸反应生成离子化合物 |
7.下列说法不正确的是( )
| A. | 使元素的化合态转化成游离态的过程可能是还原的过程 | |
| B. | 高炉炼铁的原料有铁矿石、焦炭和空气.工业上就是用焦炭还原铁矿石以制得生铁 | |
| C. | 电解熔融氧化铝时,每还原出2.7kg铝,必有300mol电子转移 | |
| D. | 工业上常用电解熔融NaCl的方法制取金属钠 |
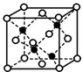 前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.
前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.