题目内容
7.某同学在实验报告中记录下列数据或操作,其中正确的是( )| A. | 用100mL量筒量取8.6mL浓硫酸 | |
| B. | 用托盘天平称量8.75g食盐 | |
| C. | 用500mL的容量瓶来配制需要的450mL溶液 | |
| D. | 用胶头滴管取5mL的某溶液 |
分析 A.量筒8.6mL浓硫酸应该选用10mL量筒;
B.托盘天平的最小读数为0.1g;
C.配制450mL溶液,选用选用规格为500mL的容量瓶;
D.胶头滴管没有刻度,无法量取一定体积的溶液.
解答 解:A.用100mL量筒量取8.6mL浓硫酸会产生较大误差,应该选用10mL量筒量取,故A错误;
B.托盘天平只能读到0.1g,无法用托盘天平称量8.75g食盐,故B错误;
C.实验室中没有450mL容量瓶,配制00mL溶液应该选用500mL的容量瓶,故C正确;
D.胶头滴管只能滴加少量溶液,且没有具体刻度,无法滴加5mL溶液,故D错误;
故选C.
点评 本题考查常见仪器的使用方法,题目难度不大,涉及量筒、托盘天平、胶头滴管的使用方法及溶液配制,明确常见仪器的构造及使用方法为解答关键,试题培养了学生的化学实验能力.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
4.从防止污染和减少用酸量的角度分析,下列制取Cu(NO3)2的方法中最好的是( )
| A. | Cu$\stackrel{浓硝酸}{→}$Cu(NO3)2 | |
| B. | Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 | |
| C. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{硝酸}{→}$Cu(NO3)2 | |
| D. | Cu$→_{△}^{浓硫酸}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
18.肼(N2H4)常用于火箭或原电池的燃料.己知:
①N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol
③H2O(g)═H2O(1)△H=-44kJ/mol
(1)2N2H4(g)+2NO2(g)═3N2(g)+4H2O(1)△H=-1311.7kJ•mol-1
(2)一定温度下,将N2H4与NO2以体积比1:1置于10L密闭容器中发生反应:2N2H4(g)+2NO2(g)?3N2(g)+4H2O(1),下列不能说明反应达到平衡状态的是ac.(填序号)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.N2H4比与NO2体积比保持不变 d.体系压强保持不变
(3)在10L的密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
前2min内NO2的平均反应速率为0.01mol/(L•min).平衡时NO2的转化率25%;(2)中反应平衡常数表达式为K=$\frac{c{\;}^{3}(N{\;}_{2})}{c{\;}^{2}(N{\;}_{2}H{\;}_{4})•c{\;}^{2}(NO{\;}_{2})}$,计算该温度下反应的平衡常数K=0.9375.反应在第6min时改变了条件,改变的条件可能是bc(填序号)
a.使用催化剂 b.升高温度 c.扩大容器容积 d.增加NO2的量
(4)若在一定温度下,(2)中反应的平衡常数为20,反应到某时刻测得N2H4、NO2、N2的溶度均为0.1mol•L-1,此时v正>v逆.
①N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol
③H2O(g)═H2O(1)△H=-44kJ/mol
(1)2N2H4(g)+2NO2(g)═3N2(g)+4H2O(1)△H=-1311.7kJ•mol-1
(2)一定温度下,将N2H4与NO2以体积比1:1置于10L密闭容器中发生反应:2N2H4(g)+2NO2(g)?3N2(g)+4H2O(1),下列不能说明反应达到平衡状态的是ac.(填序号)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.N2H4比与NO2体积比保持不变 d.体系压强保持不变
(3)在10L的密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
| 物质的量/时间 | n(N2H4) | n(NO2) | n(N2) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.3 |
| 第5min | 0.4 | 1.2 | 0.6 |
| 第6min | 0.4 | 1.2 | 0.6 |
| 第10min | 0.6 | 1.4 | 0.3 |
a.使用催化剂 b.升高温度 c.扩大容器容积 d.增加NO2的量
(4)若在一定温度下,(2)中反应的平衡常数为20,反应到某时刻测得N2H4、NO2、N2的溶度均为0.1mol•L-1,此时v正>v逆.
19.将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO).向反应后的溶液中加入 3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g.下列叙述不正确的是( )
| A. | 当生成的沉淀量达到最大时,消耗NaOH 溶液的体积V≥100 mL | |
| B. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是 0.4 mol | |
| C. | 参加反应的金属的总质量 9.6g>m>3.6g | |
| D. | 当金属全部溶解时收集到 NO气体的体积一定为2.24L |
16.交通警察使用的“司机酒后驾车检测器”是应用氧化还原反应原理制成的,其反应的化学方程式为(Cr为铬元素):4CrO3+C2H5OH+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O CrO3是一种红色固体,它在酸性条件下与酒精蒸气反应生成蓝绿色的硫酸铬,根据颜色变化来判断司机是否饮酒.下列说法不正确的是( )
| A. | CrO3是氧化剂 | |
| B. | 酒精是还原剂 | |
| C. | 当2mol CrO3被还原时,有3mol电子发生转移 | |
| D. | 当0.02mol酒精参与反应时,生成的CO2在标准状况下的体积为0.896L |
17.下列措施不利于节能减排、改善环境质量的有( )
| A. | 积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料 | |
| B. | 使用填埋法处理未经分类的生活垃圾 | |
| C. | 发展低碳经济、循环经济,推广利用太阳能、风能的城市照明系统 | |
| D. | 加速建设地铁、轻轨等轨道交通,促进武汉“8+1”城市圈-体化发展,减少汽车尾气排放 |
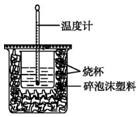 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题: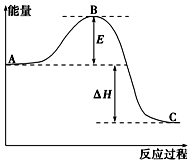 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.