题目内容
我国《车用燃料甲醇国家标准》的实施拉开了车用燃料低碳革命的大幕,一些省市正在陆续试点与推广使用甲醇汽油.甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下发生如下反应制得:CO(g)+2H2(g)?CH3OH(g).图Ⅰ、图Ⅱ是关于反应进行情况的图示.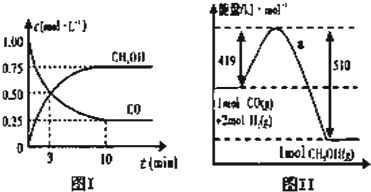
(1)图Ⅰ是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)= .
(2)图Ⅱ表示该反应进行过程中能量的变化,写出该反应的热化学方程式 .
(3)该反应的平衡常数K的表达式为 ;当温度升高时,该平衡常数K将 (填“增大”、“减小”或“不变”).
(4)恒容条件下,下列措施中能使
增大的有 .
A.升高温度 B.充入He气 C.再充入1molCO和2molH2 D.使用催化剂
(5)在恒温条件下,扩大容器体积,则平衡 (填“逆向移动”、“正向移动”、“不移动”).
(6)在温度、容积相同的三个密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下,则下列关系正确的是 .
A.c1=c2; B.Q3=2Q2; C.2P1<P3; D.α1+α2=1; E.2α2=α3 ;
F.该反应若生成1mol CH3OH放出的热量为(Q1+Q2)kJ.

(1)图Ⅰ是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=
(2)图Ⅱ表示该反应进行过程中能量的变化,写出该反应的热化学方程式
(3)该反应的平衡常数K的表达式为
(4)恒容条件下,下列措施中能使
| n(CH3OH) |
| n(CO) |
A.升高温度 B.充入He气 C.再充入1molCO和2molH2 D.使用催化剂
(5)在恒温条件下,扩大容器体积,则平衡
(6)在温度、容积相同的三个密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下,则下列关系正确的是
| 容器 | 甲 | 乙 | 丙 |
| 投料量 | 1mol CO、2mol H2 | 1mol CH3OH | 2mol CH3OH |
| CH3OH的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 吸收Q3 kJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
F.该反应若生成1mol CH3OH放出的热量为(Q1+Q2)kJ.
考点:物质的量或浓度随时间的变化曲线,反应热和焓变,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)根据图I时,反应中CO浓度的变化,结合速率公式计算;
(2)根据反应物与生成物的总能量来分析吸热还是放热,并书写热化学反应方程式;
(3)根据反应方程式结合平衡常数的含义书写;根据温度对平衡的影响分析K的变化;
(4)恒容条件下,下列措施中能使
增大,则平衡正移,据此分析;
(5)该反应是气体体积减小的反应,扩大容器体积,平衡向体积增大的方向移动,也就是平衡逆向移动,据此判断;
(6从等效平衡和平衡移动的角度分析.
(2)根据反应物与生成物的总能量来分析吸热还是放热,并书写热化学反应方程式;
(3)根据反应方程式结合平衡常数的含义书写;根据温度对平衡的影响分析K的变化;
(4)恒容条件下,下列措施中能使
| n(CH3OH) |
| n(CO) |
(5)该反应是气体体积减小的反应,扩大容器体积,平衡向体积增大的方向移动,也就是平衡逆向移动,据此判断;
(6从等效平衡和平衡移动的角度分析.
解答:
解:(1)由图I可知,反应中CO浓度的变化为:1.00-0.25=0.75mol?L-1,则c(CO)=
=
=0.075mol/(L?min),故答案为:0.075mol/(L?min);
(2)反应物的总能量为419kJ,生成物的总能量为510kJ,则该反应为放热反应,放出的热量为419kJ-510kJ=91kJ,热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol,
故答案为:CO(g)+2H2(g) CH3OH(g)△H=-91 kJ/mol;
CH3OH(g)△H=-91 kJ/mol;
(3)已知CO(g)+2H2(g)?CH3OH(g);则K=
;已知该反应的正方向为放热反应,升高温度平衡逆移,所以K减小;
故答案为:
;减小;
(4)恒容条件下,下列措施中能使
增大,则平衡正移;
A.已知该反应的正方向为放热反应,升高温度,平衡逆移,故A错误;
B.充入He气,容器的体积不变,各反应物的浓度不变,平衡不移动,故B错误;
C.再充入1molCO和2molH2,与原来加入了的量等比例,平衡时比原来的平衡的压强增大,平衡正移,故C正确;
D.使用催化剂,同等程度的改变正逆反应速率,平衡不移动,故D错误;
故选C.
(5)该反应是气体体积减小的反应,扩大容器体积,平衡向体积增大的方向移动,也就是平衡逆向移动,故答案为:逆向移动;
(6)A、甲乙为等效平衡,则有c1=c2故A正确;
B、丙的起始量为乙的2倍,而该反应为体积减小的反应,所以达到平衡时丙参加反应的CH3OH的物质的量小于乙的2倍,所以吸收的热量也小于乙的2倍,故有Q3<2Q2,故B错误;
C、甲乙为等效平衡,丙的起始量为乙的2倍,而该反应为体积减小的反应,所以达到平衡时丙参加反应的CH3OH的物质的量小于乙的2倍,所以2P1>P3;故C错误;
D、甲乙为等效平衡,但它们起始的方向正好相反,所以有α1+α2=1,故D正确;
E、甲、乙处于相同的平衡状态,则α1+α2=1,丙的起始量为乙的2倍,而该反应为体积减小的反应,所以达到平衡时丙参加反应的CH3OH的物质的量小于乙的2倍,所以α2>α3,故E错误;
F、甲乙为等效平衡,但它们起始的方向正好相反,所以有α1+α2=1,则反应CO(g)+2H2(g) ?CH3OH(g)中生成1mol CH3OH放出的热量为(Q1+Q2)kJ,故F正确;
?CH3OH(g)中生成1mol CH3OH放出的热量为(Q1+Q2)kJ,故F正确;
故选ADF.
| △c |
| t |
| 0.75mol?L |
| 10min |
(2)反应物的总能量为419kJ,生成物的总能量为510kJ,则该反应为放热反应,放出的热量为419kJ-510kJ=91kJ,热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol,
故答案为:CO(g)+2H2(g)
 CH3OH(g)△H=-91 kJ/mol;
CH3OH(g)△H=-91 kJ/mol;(3)已知CO(g)+2H2(g)?CH3OH(g);则K=
| c(CH3OH) |
| c(CO)?c2(H2) |
故答案为:
| c(CH3OH) |
| c(CO)?c2(H2) |
(4)恒容条件下,下列措施中能使
| n(CH3OH) |
| n(CO) |
A.已知该反应的正方向为放热反应,升高温度,平衡逆移,故A错误;
B.充入He气,容器的体积不变,各反应物的浓度不变,平衡不移动,故B错误;
C.再充入1molCO和2molH2,与原来加入了的量等比例,平衡时比原来的平衡的压强增大,平衡正移,故C正确;
D.使用催化剂,同等程度的改变正逆反应速率,平衡不移动,故D错误;
故选C.
(5)该反应是气体体积减小的反应,扩大容器体积,平衡向体积增大的方向移动,也就是平衡逆向移动,故答案为:逆向移动;
(6)A、甲乙为等效平衡,则有c1=c2故A正确;
B、丙的起始量为乙的2倍,而该反应为体积减小的反应,所以达到平衡时丙参加反应的CH3OH的物质的量小于乙的2倍,所以吸收的热量也小于乙的2倍,故有Q3<2Q2,故B错误;
C、甲乙为等效平衡,丙的起始量为乙的2倍,而该反应为体积减小的反应,所以达到平衡时丙参加反应的CH3OH的物质的量小于乙的2倍,所以2P1>P3;故C错误;
D、甲乙为等效平衡,但它们起始的方向正好相反,所以有α1+α2=1,故D正确;
E、甲、乙处于相同的平衡状态,则α1+α2=1,丙的起始量为乙的2倍,而该反应为体积减小的反应,所以达到平衡时丙参加反应的CH3OH的物质的量小于乙的2倍,所以α2>α3,故E错误;
F、甲乙为等效平衡,但它们起始的方向正好相反,所以有α1+α2=1,则反应CO(g)+2H2(g)
 ?CH3OH(g)中生成1mol CH3OH放出的热量为(Q1+Q2)kJ,故F正确;
?CH3OH(g)中生成1mol CH3OH放出的热量为(Q1+Q2)kJ,故F正确;故选ADF.
点评:本题为综合性习题,考查影响化学平衡的因素、热化学反应、化学平衡常数、反应速率的计算,图象的分析和利用等知识点,注重对高考热点知识的考查,是较好的习题,注意理解等效平衡问题,难度中等.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案
相关题目
下列实验操作正确的是( )
| A、给容量瓶检漏时,向容量瓶中注入适量水,左手托住瓶底右食指顶住瓶塞,倒置数次,观察是否漏水 |
| B、具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 |
| C、配制一定物质的量浓度的溶液时,蒸馏水洗净后容量瓶未干燥,不影响测定结果 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
常温下把氨水滴到盐酸中,当c(NH4+)=c(Cl-)时,混合液的pH值( )
| A、等于7 | B、大于7 |
| C、小于7 | D、无法判断 |
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题: 合成氨和制备硝酸是两种重要的化工生产,重庆某化工厂将合成氨与制备硝酸进行连续生产.
合成氨和制备硝酸是两种重要的化工生产,重庆某化工厂将合成氨与制备硝酸进行连续生产. 2014年3月9日凌晨,一辆拖挂车装载150桶约30吨白磷驶往山东,在雅西高速西昌收费站附近发生侧翻,车上白磷泄漏燃烧,大量白色烟雾飘进西昌城区.
2014年3月9日凌晨,一辆拖挂车装载150桶约30吨白磷驶往山东,在雅西高速西昌收费站附近发生侧翻,车上白磷泄漏燃烧,大量白色烟雾飘进西昌城区.