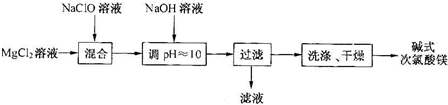
题目内容
将两份质量均为m g的铝和镁的混合物,分别投入到足量的NaOH溶液和盐酸中,生成H2在同温同压下的体积比为1:2,则原混合物中铝与镁的物质的量之比为( )
| A、1:2 | B、1:3 |
| C、3:1 | D、2:3 |
考点:有关混合物反应的计算
专题:计算题
分析:只有Al和NaOH溶液反应生成氢气,Mg和Al都与HCl反应生成氢气,NaOH溶液和稀盐酸足量,所以与盐酸反应生成的氢气减去与NaOH溶液生成的氢气就是Mg和盐酸生成的氢气,根据生成氢气的量计算Al、Mg的物质的量之比.
解答:
解:相同条件下,气体体积之比等于其物质的量之比,
只有Al和NaOH溶液反应生成氢气,Mg和Al都与HCl反应生成氢气,
设生成H2的物质的量分别为1 mol、2 mol,
在NaOH溶液中:2Al~3H2,生成1mol氢气需Al的物质的量
mol;
在盐酸中:
mol Al生成1 mol H2,Mg生成(2 mol-1 mol)=1 mol,
由Mg~H2,需n(Mg)=n(H2)=1 mol,
所以n(Al):n(Mg)=
mol:1mol=2:3,
故选D.
只有Al和NaOH溶液反应生成氢气,Mg和Al都与HCl反应生成氢气,
设生成H2的物质的量分别为1 mol、2 mol,
在NaOH溶液中:2Al~3H2,生成1mol氢气需Al的物质的量
| 2 |
| 3 |
在盐酸中:
| 2 |
| 3 |
由Mg~H2,需n(Mg)=n(H2)=1 mol,
所以n(Al):n(Mg)=
| 2 |
| 3 |
故选D.
点评:本题考查混合物反应的计算,侧重考查学生分析、计算能力,明确只有Al和NaOH溶液反应是解本题关键,利用关系式解答即可,题目难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
下列气体中能用浓硫酸干燥的是( )
| A、H2S |
| B、NH3 |
| C、HI |
| D、CO2 |
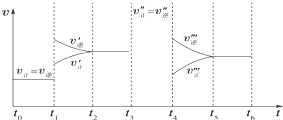 密闭容器中发生如下反应:A(g)+3B(g)?2C(g);△H<0,根据下列速率-时间图象,下列说法不正确的是( )
密闭容器中发生如下反应:A(g)+3B(g)?2C(g);△H<0,根据下列速率-时间图象,下列说法不正确的是( )| A、下列时刻所改变的外界条件是:t1升温;t3加催化剂;t4减压 |
| B、产物C的体积分数最大的时间段是t0~t1段 |
| C、上述图象中C的体积分数相等的时间段是t2~t3段与t3~t4段 |
| D、反应速率最大的时间段是t0~t1段 |