题目内容
10.已知CH3COO-+H+?CH3COOH现要使平衡向右移动且氢离子浓度增大,应采取的措施是BA.加NaOH B.加盐酸 C.加水 D.升高温度
已知CH3COOH在溶剂A中可以全部电离,盐不溶解于A溶剂.则CH3COOH和Na2CO3在溶剂A中生成CO2反应的离子方程式是Na2CO3+2H++2CH3COO-=2CH3COONa+H2O+CO2↑.
分析 CH3COO-+H+?CH3COOH现要使平衡向右移动且氢离子浓度增大,应是增大氢离子浓度;已知CH3COOH在溶剂A中可以全部电离,盐不溶解于A溶剂.所以碳酸钠和生成的醋酸钠不能写成离子,醋酸完全电离,据此书写离子方程式.
解答 解:已知CH3COO-+H+?CH3COOH现要使平衡向右移动且氢离子浓度增大,
A.加入氢氧化钠和氢离子反应平衡左移,氢离子浓度减小,故A错误;
B.加入盐酸,氢离子浓度增大,平衡在进行,故B正确,
C.加入水平衡逆向进行,氢离子浓度减小,故C错误;
D.升高温度,平衡向逆向进行,故D错误;
故选B.
已知CH3COOH在溶剂A中可以全部电离,盐不溶解于A溶剂.所以碳酸钠和生成的醋酸钠不能写成离子,醋酸完全电离,据此书写离子方程式:Na2CO3+2H++2CH3COO-=2CH3COONa+H2O+CO2↑,
故答案为:B; Na2CO3+2H++2CH3COO-=2CH3COONa+H2O+CO2↑.
点评 本题考查了弱电解质电离平衡影响因素分析、物质在不同溶剂中的存在形式不同,离子方程式书写需要依据条件来书写,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.实验室可用如图装置(启普发生器)制取氢气.欲使得到氢气的速率加快,下列措施可行的是( )


| A. | 将稀硫酸改用浓硫酸 | B. | 向稀硫酸中加入少量硫酸铜溶液 | ||
| C. | 向稀硫酸中加入硫酸钠固体 | D. | 给装置中发生反应的部分加热 |
18.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4 L CCl4含有4NA个Cl原子 | |
| B. | 16gO2和O3组成的混合气体中含有的原子数为NA | |
| C. | 1 mol Na2O2与足量H2O完全反应,转移电子数为2 NA | |
| D. | 78g Na2O2所含的阴离子数为2NA |
5.下列化合物在核磁共振氢谱中能出现两组峰,且其峰面积之比为3:1的是( )
| A. | 苯 | B. | 乙酸乙酯 | C. | 乙醛 | D. | 对二甲苯 |
15.下列有关物质用途的说法中,不正确的是( )
| A. | SiO2是制造光导纤维的材料 | B. | Fe3O4常用于红色油漆和涂料 | ||
| C. | Na2SiO3常用作制木材防火剂 | D. | NaHCO3常用作面粉发泡剂 |
2.用石墨作电极,电解1mol/L下列物质的溶液,溶液的pH保持不变的是( )
| A. | NaNO3 | B. | NaOH | C. | HCl | D. | NaCl |
19.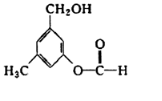 有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )
有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )
①可以使溴水褪色
②可以和NaHCO3溶液反应
③在一定条件下可以和氢气发生反应
④在一定条件下可以发生消去反应
⑤在一定条件下可以发生银镜反应.
 有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )
有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )①可以使溴水褪色
②可以和NaHCO3溶液反应
③在一定条件下可以和氢气发生反应
④在一定条件下可以发生消去反应
⑤在一定条件下可以发生银镜反应.
| A. | ①②③ | B. | ①③⑤ | C. | ①②④ | D. | ③④⑤ |
20.(1)碳酸钠溶液中各离子按照浓度从大到小的顺序依次为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
(2)下表是几种常见弱酸的电离平衡常数(25℃)
根据分析表格中数据可知,H2CO3、CH3COOH、HClO 三种酸的酸性从强到弱依次是CH3COOH>H2CO3>HClO;25℃时,等浓度的Na2CO3、NaAc 和NaClO三种溶液的pH从小到大依次是NaAc<NaClO<Na2CO3.
(3)常温下,将0.02mol•L-1 的 Ba(OH)2溶液100mL和0.02mol•L-1的NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为12.
(4)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11. 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,MgF2(填化学式)溶液中的 c(Mg2+)大.
(2)下表是几种常见弱酸的电离平衡常数(25℃)
| 酸 | H2CO3 | CH3COOH | HClO |
| K | K1=4.4×10-7;K 2=4.7×10-11 | K=1.76×10-5 | K=2.95×10-8 |
(3)常温下,将0.02mol•L-1 的 Ba(OH)2溶液100mL和0.02mol•L-1的NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为12.
(4)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11. 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,MgF2(填化学式)溶液中的 c(Mg2+)大.