题目内容
(1)分别取Wg钠、镁、铝与足量的盐酸反应,在相同条件下产生H2的体积比 .
(2)分别取0.1mol 钠、镁、铝与足量的盐酸反应,在相同条件下产生H2的体积比是 .
(3)若产生相同物质的量的H2,所需钠、镁、铝的质量比为 .
(4)若产生相同体积(同温同压下)的H2,所需的钠、镁、铝物质的量比为 .
(5)若将0.2mol钠、镁、铝分别投入到10mL 1mol?L-1的盐酸中,在标准状况下,产生体积H2的大小顺序是 .
(2)分别取0.1mol 钠、镁、铝与足量的盐酸反应,在相同条件下产生H2的体积比是
(3)若产生相同物质的量的H2,所需钠、镁、铝的质量比为
(4)若产生相同体积(同温同压下)的H2,所需的钠、镁、铝物质的量比为
(5)若将0.2mol钠、镁、铝分别投入到10mL 1mol?L-1的盐酸中,在标准状况下,产生体积H2的大小顺序是
考点:化学方程式的有关计算
专题:计算题
分析:发生反应:2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,根据方程式计算解答.
解答:
解:(1)2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,
46g 1mol 24g 1mol 54g 1mol
Wg
mol Wg
mol Wg
mol
故在相同条件下产生氢气的体积比=
mol:
mol:
mol=
:
:
,
故答案为:
:
:
;
(2)分别取0.1mol钠、镁、铝与足量盐酸反应,则:
2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,
0.1mol 0.05mol 0.1mol 0.1mol 0.1mol 0.15mol
故在相同条件下产生氢气的体积比=0.05mol:0.1mol:0.15mol=1:2:3,
故答案为:1:2:3;
(3)产生相同物质的量的氢气,设氢气为3mol,则:
2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,
6mol 3mol 3mol 3mol 2mol 3mol
故所需钠、镁、铝的物质的量之比=6mol:3mol:2mol=6:3:2,
则质量比=6×23:3×24::2×27=23:12:9,
故答案为:23:12:9;
(4)若产生相同体积(同温同压下)的H2,说明三种金属提供电子的物质的量相同,设三种金属都失去6mol的电子,需钠的物质的量为6mol,镁的物质的量为3mol,铝的物质的量为2mol,所以所需的钠、镁、铝物质的量比为6:3:2,故答案为:6:3:2;
(5)若将三种金属各0.2mol分别投入10mL1mol/L的盐酸中,可知三种金属都过量,但金属钠活泼,能与水反应生成氢气,则生成氢气最多的是钠,镁和铝生成氢气的体积一样多,故答案为:Na>Mg=Al.
46g 1mol 24g 1mol 54g 1mol
Wg
| W |
| 46 |
| W |
| 24 |
| W |
| 54 |
故在相同条件下产生氢气的体积比=
| W |
| 46 |
| W |
| 24 |
| W |
| 54 |
| 1 |
| 23 |
| 1 |
| 12 |
| 1 |
| 9 |
故答案为:
| 1 |
| 23 |
| 1 |
| 12 |
| 1 |
| 9 |
(2)分别取0.1mol钠、镁、铝与足量盐酸反应,则:
2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,
0.1mol 0.05mol 0.1mol 0.1mol 0.1mol 0.15mol
故在相同条件下产生氢气的体积比=0.05mol:0.1mol:0.15mol=1:2:3,
故答案为:1:2:3;
(3)产生相同物质的量的氢气,设氢气为3mol,则:
2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,
6mol 3mol 3mol 3mol 2mol 3mol
故所需钠、镁、铝的物质的量之比=6mol:3mol:2mol=6:3:2,
则质量比=6×23:3×24::2×27=23:12:9,
故答案为:23:12:9;
(4)若产生相同体积(同温同压下)的H2,说明三种金属提供电子的物质的量相同,设三种金属都失去6mol的电子,需钠的物质的量为6mol,镁的物质的量为3mol,铝的物质的量为2mol,所以所需的钠、镁、铝物质的量比为6:3:2,故答案为:6:3:2;
(5)若将三种金属各0.2mol分别投入10mL1mol/L的盐酸中,可知三种金属都过量,但金属钠活泼,能与水反应生成氢气,则生成氢气最多的是钠,镁和铝生成氢气的体积一样多,故答案为:Na>Mg=Al.
点评:本题考查根据方程式进行的计算,比较基础,利用电子转移守恒进行更为简单,掌握化学方程式基本计算方法是关键.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O═CH3COOH+4H+.下列有关说法正确的是( )
| A、检测时,电解质溶液中的H+向负极移动 |
| B、电池反应的化学方程式为CH3CH2OH+O2═CH3COOH+H2O |
| C、正极上发生的反应为:O2+4e-+2H2O═4OH- |
| D、若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气 |
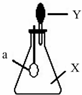 如图,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体 Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )
如图,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体 Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )| A、X是NH3,Y是水 |
| B、X是CO2,Y是稀硫酸 |
| C、X是SO2,Y是NaOH浓溶液 |
| D、X是 HCl,Y是NaNO3 稀溶液 |
在一定条件下,使 CO 和 O2的混合气体22g充分反应,所得混合物在常温下跟足量Na2O2 固体反应,结果固体增重14g,则原混合气体中O2 和CO的质量比是( )
| A、1:2 | B、3:8 |
| C、5:6 | D、4:7 |
下列做法中不正确的是( )
| A、做喷泉实验来验证氨气极易溶解于水的性质 |
| B、金属钠着火时不可以用泡沫灭火器,可用干燥的沙土灭火 |
| C、用NaOH溶液除去混在CO2气体中的HCl |
| D、实验室中保存FeSO4溶液,应向其中加入铁粉 |
将蔗糖用少量水湿润后,一边搅拌一边加入浓硫酸.可以看到蔗糖颜色逐渐变黑,体积不断膨胀,最后变成多孔疏松固体.上述过程中,体现出浓硫酸( )
| A、只有吸水性 |
| B、只有脱水性 |
| C、既有吸水性.又有脱水性 |
| D、有脱水性、吸水性、氧化性 |

 X2是人体呼吸中不可缺少的气体,Y是地壳中含量最多的金属元素,Z元素的焰色为黄色,W2是一种黄绿色气体.请回答下列问题:
X2是人体呼吸中不可缺少的气体,Y是地壳中含量最多的金属元素,Z元素的焰色为黄色,W2是一种黄绿色气体.请回答下列问题: