题目内容
4.下列排列顺序不正确的是( )| A. | 非金属性:F>Cl>S | B. | 熔点:SiO2>KCl>I2 | ||
| C. | 稳定性:HF>H2S>H2O | D. | 碱性:KOH>NaOH>Al(OH)3 |
分析 A.同周期非金属性从左向右增强,同主族从上到下非金属性减弱;
B.熔点的一般规律:原子晶体>离子晶体>分子晶体;
C.非金属性越强,气态氢化物越稳定;
D.金属性越强,最高价氧化物的水化物的碱性越强.
解答 解:A.F、Cl同主族,S、Cl同周期,则非金属性F>Cl>S,故A正确;
B.熔点的一般规律:原子晶体>离子晶体>分子晶体,已知SiO2为原子晶体,KCl为离子晶体,I2为分子晶体,则熔点:SiO2>KCl>I2,故B正确;
C.非金属性F>O>S,则稳定性为HF>H2O>H2S,故C错误;
D.金属性K>Na>Al,则最高价氧化物的水化物的碱性KOH>NaOH>Al(OH)3,故D正确;
故选C.
点评 本题考查位置、结构、性质的关系,熟悉位置及元素周期律即可解答,题目难度不大.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
14. 体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )
体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )
 体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )
体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )| A. | 曲线a是500℃时的图象 | |
| B. | 从0到t1时刻,反应物X(g)的$\frac{v(300℃)}{v(500℃)}$>1 | |
| C. | t2时刻生成物Z的量$\frac{{△v}_{1}(300℃)}{{△v}_{1}(500℃)}$ | |
| D. | t3时刻改变的条件可能是降温 |
12.下列关于元素周期表和元素周期律的说法错误的是( )
| A. | Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 | |
| B. | 第二周期元素从Li到F,非金属性逐渐增强 | |
| C. | 因为Al比Mg失去电子数多,所以Al比Mg的还原性强 | |
| D. | O与S为同主族元素,且O比S的非金属性强 |
19.下列叙述正确的是( )
| A. | 在共价化合物中一定存在共价键 | |
| B. | 只存在共价键的物质一定是共价化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 离子化合物中只含有离子键 |
9.下列各物质中,互为同系物的是( )
| A. | 氯仿和氯乙烷 | B. | HCOOCH3和CH3COOH | ||
| C. | 油酸和硬脂酸 | D. | C3H8和C17H36 |
16.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 检验蔗糖水解产物中的葡萄糖 | 取1mL 20%蔗糖溶液,加入少量稀硫酸,水浴加热后取少量溶液于另一试管中,加入几滴新制Cu(OH)2,加热 |
| B | 除去乙烷中混有的少量乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
| C | 检验葡萄糖中含有醛基 | 向3mL 2%氨水溶液中加入几滴2%的硝酸银溶液,再加入1mL10%的葡萄糖溶液温水浴加热几分钟 |
| D | 验证蛋白质的盐析 | 向豆浆、鸡蛋清溶液中均滴加饱和硫酸铵溶液,振荡至出现沉淀,再向沉淀物中加入蒸馏水,不断振荡 |
| A. | A | B. | B | C. | C | D. | D |
13.不论以何种比例混合,只要混合物的质量一定,完全燃烧后生成CO2的量也一定的一组物质是( )
| A. | 甲苯和乙苯 | B. | 乙烯和丁烯 | C. | 甲烷和丙烯 | D. | 乙炔和丁炔 |
14.下列说法不正确的是( )
| A. | 溶液中滴加盐酸酸化的BaCl2溶液出现被色沉淀,则溶液中不一定存在SO${\;}_{4}^{2-}$ | |
| B. | 形成酸雨的氧化物主要是SO2和氮的氧化物,CO2是造成温室效应的主要气体 | |
| C. | 氯气泄漏自救方法是用湿毛巾或蘸有纯碱水的毛巾捂住口鼻并向地势低的地方撤离 | |
| D. | 大气中的N2可转化为NO,NO可转化为NO2、硝酸等,含硫物质在自然界中可转化为SO2等含硫化合物 |
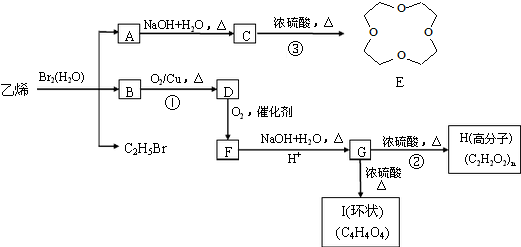
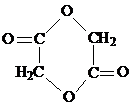 .
.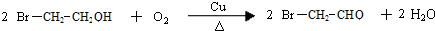 .写出反应 ②的化学方程式
.写出反应 ②的化学方程式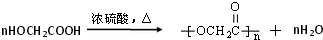 .
.