题目内容
18.某原电池总反应的离子方程式为:2Fe3++Fe═3Fe2+,不能实现该反应的原电池是( )| A. | 正极为Cu,负极为Fe,电解质为FeCl3溶液 | |
| B. | 正极为C,负极为Fe,电解质为Fe(NO3)3溶液 | |
| C. | 正极为Fe,负极为Zn,电解质为Fe2(SO4)3溶液 | |
| D. | 正极为Ag,负极为Fe,电解质为CuSO4溶液 |
分析 根据2Fe3++Fe=3Fe2+知,铁易失电子而作负极,不如铁活泼的金属或导电的非金属作正极,铁离子得电子发生还原反应,所以电解质溶液为可溶性的铁盐,据此分析解答.
解答 解:根据2Fe3++Fe=3Fe2+知,铁易失电子而作负极,不如铁活泼的金属或导电的非金属作正极,铁离子得电子发生还原反应,所以电解质溶液为可溶性的铁盐,
A.铁作负极,铜作正极,电解质为可溶性的氯化铁,则符合题意,故A不选;
B.铁作负极,碳作正极,电解质为可溶性的硝酸铁,则符合题意,故B不选;
C.铁作正极,锌作负极,电解质为可溶性的硫酸铁,电池总反应为:2Fe3++Zn═2Fe2++Zn2+,则不符合题意,故C选;
D.铁作负极,银作正极,电解质为可溶性的铁盐而不是铜盐,则不符合条件,所以不能构成该条件下的原电池,故D选;
故选CD.
点评 本题考查了原电池中正负极及电解质溶液的判断,根据得失电子判断正负极及电解质,难度中等.

练习册系列答案
相关题目
17.NA为表阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 9 g38903Sr2+中含有的电子数为3.6 NA | |
| B. | 某温度下纯水的pH=6,该温度下1L pH=11的NaOH溶液中含OH-的数目为0.1NA | |
| C. | 一定温度下,1 L 0.5 mol•L-1 NH4Cl溶液与2 L 0.25 mol•L-1NH4Cl溶液含NH4+均为0.5NA | |
| D. | 丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA |
18.通过NO传感器可监测汽车排放尾气中NO含量,其工作原理如图所示,下列说法正确的是( )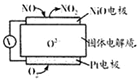

| A. | O2-向正极移动 | |
| B. | 负极的电极反应式为:NO-2e-+O2-═NO2 | |
| C. | O2的电极反应产物是H2O | |
| D. | 反应消耗的NO与O2的物质的量之比为l:2 |
6.已知H2O跟H+可结合成H3O+(称为水合氢离子),则H3O+中一定含有的化学键是( )
| A. | 离子键 | B. | 非极性键 | C. | 配位键 | D. | 氢键 |
13.下列说法或表示法错误的是( )
| A. | 吸热反应是由于反应物的总能量比生成物的总能量低 | |
| B. | 放热反应的△H<0 | |
| C. | 需要加热才能发生反应一定是吸热反应 | |
| D. | 酸碱中和反应都是放热反应 |
10.下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A. | 金属氧化物 氧化铁 FeO | B. | 非金属氧化物 二氧化硫 SO2 | ||
| C. | 酸 次氯酸 HClO3 | D. | 碱 纯碱 Na2CO3 |
7.a、b、c、d为短周期元素,a的M电子层有l个电子,b的一种核素14b常用于鉴定文物年代,c的最高化合价与最低化合价代数和为4,d的正一价含氧酸能杀菌、消毒、漂白.下列叙述错误的是( )
| A. | 最高价含氧酸酸性:d>c>b | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | c 的单质难溶于水,微溶于酒精,易溶于bc2 | |
| D. | b、c、d分别与氢形成的化合物中化学键均为极性共价键 |
8.除去下列物质中的杂质(括号中为杂质)只选用给出试剂(不考虑操作),正确的是( )
| A. | Al2O3(Fe2O3)用盐酸 | B. | Al2O3(SiO2)用氢氧化钠溶液 | ||
| C. | NaHCO3溶液(Na2CO3)通入过量CO2 | D. | NaHCO3溶液(Na2SiO3)通入过量CO2 |
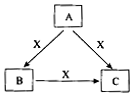 A、B、C、X是中学化学常见化合物,均由短周期元素组成,转化关系如图所示. 若A、B、C的焰色反应均呈黄色,水溶液均为碱性.
A、B、C、X是中学化学常见化合物,均由短周期元素组成,转化关系如图所示. 若A、B、C的焰色反应均呈黄色,水溶液均为碱性.