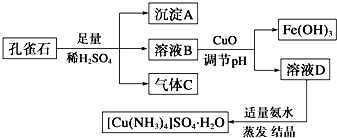
题目内容
现有镁铝合金5.1g,与足量的盐酸反应,在标准状况下放出氢气5.6L,求铝的质量分数.
考点:化学方程式的有关计算
专题:计算题
分析:发生反应Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,令金属中Mg的物质的量为xmol、Al的物质的量为ymol,结合二者质量与生成气体的体积,列方程计算x、y的值,根据m=nM计算合金中Mg的质量,镁铝合金中镁的质量分数=
×100%;
| Al的质量 |
| 镁铝合金质量 |
解答:
解:(1)5.6L氢气的物质的量为
=0.25mol,
令金属中Mg的物质的量为xmol、Al的物质的量为ymol,则:
Mg+2HCl=MgCl2+H2↑,
xmol xmol
2Al+6HCl=2AlCl3+3H2↑
ymol 1.5ymol
所以
解得:x=0.1,y=0.1
5.1g合金中Al的物质的量为0.1mol,合金中Al的质量为0.1mol×27g/mol=2.7g,镁铝合金中镁的质量分数=
×100%=52.9%,
答:合金中铝的质量分数为52.9%.
| 5.6L |
| 22.4L/mol |
令金属中Mg的物质的量为xmol、Al的物质的量为ymol,则:
Mg+2HCl=MgCl2+H2↑,
xmol xmol
2Al+6HCl=2AlCl3+3H2↑
ymol 1.5ymol
所以
|
解得:x=0.1,y=0.1
5.1g合金中Al的物质的量为0.1mol,合金中Al的质量为0.1mol×27g/mol=2.7g,镁铝合金中镁的质量分数=
| 2.7g |
| 5.1g |
答:合金中铝的质量分数为52.9%.
点评:考查混合物反应的有关计算,难度不大,清楚反应是解题的关键,注意基础知识掌握.

练习册系列答案
相关题目
下列各反应中,不属于氧化还原反应的是( )
| A、2Mg+CO2=2MgO+C |
| B、2FeCl3+Fe=3 FeCl2 |
| C、SiO2+2C=Si+2CO↑ |
| D、Mg(OH)2+2HCl=MgCl2+2H2O |
工业上在约850℃时,用金属钠与熔融的氯化钾来制取金属钾,采取用真空抽取出金属钾蒸气的方法,Na(l)+KCl(l)
K(g)+NaCl(l)△H>0,对该反应的说法不正确的是( )
| ||
| A、该反应能正向进行是因为正反应为熵增反应 |
| B、因为K在此温度下为气体,且采用真空抽走的方法,从反应体系中脱离,有利于反应的进行 |
| C、该反应说明了Na的还原性比K强 |
| D、该可逆反应为置换反应 |
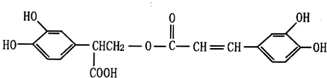
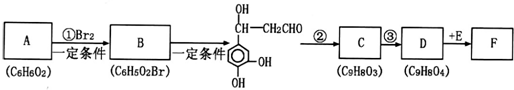

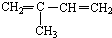 与Br2按物质的量之比1:1发生1,4加成反应方程式
与Br2按物质的量之比1:1发生1,4加成反应方程式