题目内容
下列是某同学对相应反应的离子方程式所作的评价,其中对应的评价合理的是( )
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 把MgSO4溶液滴入Ba(OH)2溶液 | Mg2++2OH-═Mg(OH)2↓ | 正确 |
| B | 向小苏打溶液中加足量氢氧化钠溶液 | HCO3-+OH-═CO2↑+H2O | 正确 |
| C | 向FeCl2溶液中通入氯气 | 2Fe2++Cl2═2Fe3++2Cl- | 不正确 |
| D | 氧化钙与稀盐酸反应 | CaO+2H+═Ca2++H2O | 正确 |
| A、A | B、B | C、C | D、D |
考点:离子方程式的书写
专题:
分析:A.漏掉了钡离子与氢氧根离子的反应;
B.不符合反应的客观事实,碳酸氢钠与氢氧化钠反应生成碳酸钠和水;
C.氯气与氯化亚铁反应生成氯化铁;
D.氧化钙与稀盐酸反应生成氯化钙和水.
B.不符合反应的客观事实,碳酸氢钠与氢氧化钠反应生成碳酸钠和水;
C.氯气与氯化亚铁反应生成氯化铁;
D.氧化钙与稀盐酸反应生成氯化钙和水.
解答:
解:A.把MgSO4溶液滴入Ba(OH)2溶液,反应的离子方程式为:Ba2++SO42-+Mg2++2OH-═Mg(OH)2↓+BaSO4↓,评价错误,故A错误;
B.向小苏打溶液中加足量氢氧化钠溶液,离子方程式:HCO3-+OH-═CO32-+H2O,评价错误,故B错误;
C.向FeCl2溶液中通入氯气,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,评价错误,故C错误;
D.氧化钙与稀盐酸反应的离子方程式为:CaO+2H+═Ca2++H2O,评价正确,故D正确;
故选:D.
B.向小苏打溶液中加足量氢氧化钠溶液,离子方程式:HCO3-+OH-═CO32-+H2O,评价错误,故B错误;
C.向FeCl2溶液中通入氯气,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,评价错误,故C错误;
D.氧化钙与稀盐酸反应的离子方程式为:CaO+2H+═Ca2++H2O,评价正确,故D正确;
故选:D.
点评:本题考查了离子方程式的书写,明确反应的事实是解题关键,注意离子方程式书写应遵循客观事实、遵循原子个数守恒、电荷数守恒规律.

练习册系列答案
相关题目
反应2A+3B=C+2D在2L的密闭容器中进行,半分钟后,C的物质的量增加了0.3mol,则此反应的平均速率表达正确的是( )
| A、v(C)=0.01 mol?L-1?s-1 |
| B、v(B)=0.03 mol?L-1?s-1 |
| C、v(A)=0.01 mol?L-1?s-1 |
| D、v(D)=0.02 mol?L-1?s-1 |
下列关于反应热的表述正确的是( )
| A、当△H为“-”时,表示该反应为放热反应 | ||
B、已知C(s)+
| ||
| C、反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | ||
| D、1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,放出的热量:CH3COOH<HNO3 |
下列说法正确的是( )
| A、离子化合物中一定含有离子键 |
| B、含有共价键的化合物一定是共价化合物 |
| C、强电解质与弱电解质的划分标准是电解质在水溶液中导电能力的强弱 |
| D、氧气中氧元素的化合价为0,所以氧分子中没有化学键 |
下列离子方程式表达正确的是( )
| A、铁粉加入到FeCl3溶液中:Fe+Fe3+=2Fe2+ |
| B、过量的氨水滴加到氯化铝溶液:Al3++4OH-═AlO2-+2H2O |
| C、氯气与水反应:Cl2+H2O═Cl-+2H++ClO- |
| D、硅酸钠溶液中通入过量CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- |
下列物质的分类合理的是( )
| A、酸性氧化物:Na2O、CaO、CuO |
| B、碱:烧碱、纯碱、苛性钾 |
| C、盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3?H2O |
| D、氧化物:CO2、NO、SO2、H2O |
如图是高中化学教科书中元素周期表的一部分,下列说法中正确的是( )
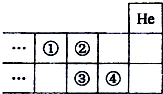

| A、①的气态氢化物比②的稳定 |
| B、②的最高价含氧酸的酸性比③强 |
| C、③的非金属性比④强 |
| D、④的原子半径比③小 |
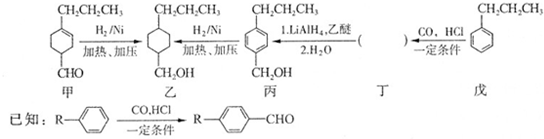
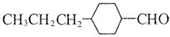 和
和