题目内容
在下列有机物中加入相应试剂和产生的现象均正确的是( )
| 选项 | 有机物 | 加入试剂 | 现象 |
| A | 苯 | 浓溴水 | 出现油状物 |
| B | 甲苯 | 酸性高锰酸钾溶液 | 紫红色变浅或消失 |
| C | 葡萄糖 | 新制氢氧化铜、加热 | 产生红色沉淀 |
| D | 溴乙烷 | 硝酸银溶液 | 产生淡黄色沉淀 |
| A、A | B、B | C、C | D、D |
考点:有机化学反应的综合应用
专题:有机反应
分析:A.苯与浓溴水不反应;
B.甲苯可与酸性高锰酸钾发生氧化还原反应;
C.葡萄糖具有醛基,能与新制氢氧化铜反应;
D.溴乙烷不能电离出溴离子.
B.甲苯可与酸性高锰酸钾发生氧化还原反应;
C.葡萄糖具有醛基,能与新制氢氧化铜反应;
D.溴乙烷不能电离出溴离子.
解答:
解:A.苯与浓溴水不反应,苯与液溴在三溴化铁催化作用下反应生成溴苯,苯与溴水混合会发生萃取分层,故A错误;
B.甲苯可与酸性高锰酸钾发生氧化还原反应,所以酸性高锰酸钾溶液与甲苯混合,高锰酸钾的紫红色变浅或消失,故B正确;
C.葡萄糖具有醛基,能与新制氢氧化铜反应生成氧化亚铜,所以产生红色沉淀,故C正确;
D.溴乙烷不能电离出溴离子,则在溴乙烷中加入硝酸银溶液不反应,所以不能产生淡黄色沉淀,故D错误.
故选BC.
B.甲苯可与酸性高锰酸钾发生氧化还原反应,所以酸性高锰酸钾溶液与甲苯混合,高锰酸钾的紫红色变浅或消失,故B正确;
C.葡萄糖具有醛基,能与新制氢氧化铜反应生成氧化亚铜,所以产生红色沉淀,故C正确;
D.溴乙烷不能电离出溴离子,则在溴乙烷中加入硝酸银溶液不反应,所以不能产生淡黄色沉淀,故D错误.
故选BC.
点评:本题考查了有机物的性质和鉴别,难度不大,注意常见有机物的显色反应和相关性质,学习中注意积累.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
煤化工生产中常研究不同温度下平衡常数、投料比及产率等问题.已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:则下列说法错误的是( )
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A、在830℃,等物质的量的CO和H2O反应达到平衡时,CO的转化率为50% |
| B、在500℃时,反应达到平衡后,增大压强,化学平衡常数K减小 |
| C、恒温、恒容条件下,若混合气体的平均相对分子质量一定,不能确定可逆反应是否达到平衡 |
| D、上述正向反应是放热反应 |
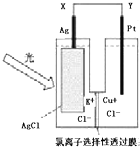 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)═AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e--→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)═AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e--→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )| A、光照时,电流由Y流向X |
| B、光照时,Pt电极发生的反应为2Cl-+2e-═Cl2光 |
| C、光照时,Cl-向Ag电极移动 |
| D、光照时,电池总反应为:AgCl(s)+Cu+(aq)═Ag (s)+Cu2+(aq)+Cl-(aq) |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温下,1L0.1mol/L的NH4NO3溶液中氮原子数为0.2 NA |
| B、1mol羟基中电子数为10 NA |
| C、2.4g金属镁变为镁离子时失去的电子数为0.1NA |
| D、常温常压下乙烯中C-H键数为4NA |
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )

| A、X和R在同一周期 |
| B、原子半径:W>R>X |
| C、气态氢化物的稳定性:Y>X |
| D、X、Z形成的化合物中不可能含有共价键 |
下列关于氯气的说法正确的是( )
| A、难溶于水 | B、无色无味 |
| C、具有漂白性 | D、有毒的气体 |
对下列有机反应类型的认识中,不正确的是( )
A、2CH3CH2OH+O2
| |||
B、CH3COOH+CH3CH2OH
| |||
C、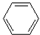 +HNO3 +HNO3
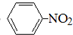 +H2O;取代反应 +H2O;取代反应 | |||
| D、CH2═CH2+Br2→CH2Br-CH2Br;加成反应 |
下列各选项所描述的两个量中,前者一定大于后者的是( )
| A、pH=3的盐酸的Cl-浓度和pH=3的醋酸溶液的CH3COO-浓度 |
| B、pH相同的氨水和醋酸钠溶液中,由水电离产生的c(H+) |
| C、0.1mol/L的盐酸和0.1mol/L的醋酸分别与金属镁反应的速率 |
| D、pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH |
在下列反应中,硫酸只起催化作用的是( )
| A、乙醇和乙酸酯化 |
| B、苯的硝化反应 |
| C、乙酸乙酯水解 |
| D、乙醇在170℃时脱水生成乙烯 |