题目内容
6.用NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 10g46%的乙醇溶液所含氢原子数为1.2 NA | |
| B. | 0.5 mol Na2O2中含有的离子数目为2NA | |
| C. | 标准状况下,2.24 L甲醇中含有C-H键的数目为0.3NA | |
| D. | S2和S8的混合物共38.4 g,其中所含硫原子数为1.4NA |
分析 A、乙醇溶液中除了乙醇外,水也含H原子;
B、过氧化钠由2个钠离子和1个过氧根构成;
C、标况下甲醇为液体;
D、S2和S8均由S原子构成.
解答 解:A、乙醇溶液中除了乙醇外,水也含H原子,10g 46%的乙醇溶液中含有的乙醇的质量为4.6g,物质的量为0.1mol,则含0.6NA个H原子;水的质量为5.4g,物质的量为0.3mol,则含0.6NA个H原子,故共1.2NA个H原子,故A正确;
B、过氧化钠由2个钠离子和1个过氧根构成,故0.5mol过氧化钠中含有1.5NA个离子,故B错误;
C、标况下甲醇为液体,故不能根据气体摩尔体积来计算其物质的量和含有的C-H键个数,故C错误;
D、S2和S8均由S原子构成,故38.4g混合物中含有的硫原子的物质的量为n=$\frac{38.4g}{16g/mol}$=2.4mol,故个数为2.4NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | 某试样焰色反应呈黄色,则试样中可能含有K+ | |
| B. | 广泛pH试纸测得某新制氯水的pH为4 | |
| C. | 配制240ml某溶液,应选240ml容量瓶 | |
| D. | 可用排饱和食盐水来收集纯净的氯气 |
17.下列反应不属于取代反应的是( )
| A. | 苯与浓硫酸反应 | B. | 乙醇与HBr溶液共热制溴乙烷 | ||
| C. | 乙醇和浓硫酸共热至170℃ | D. | 油脂与强碱水溶液反应 |
1.下列说法正确的是( )
| A. | 石油的分馏、煤的干馏都是物理变化 | |
| B. | 化学反应的限度是不可改变的 | |
| C. | 可用乙醇萃取溴水中的溴 | |
| D. | 在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料 |
11.设NA表示阿伏加德罗常数的值,下列叙述中一定正确的是( )
| A. | 1 mol C4H10分子中共价键总数为13NA | |
| B. | 1L 1mol•L-1 盐酸中,含有HCl分子数为NA | |
| C. | 18g D2O 中含有的质子数和电子数均为10NA | |
| D. | 1molCl2与Fe 反应转移的电子数目为3NA |
15.工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
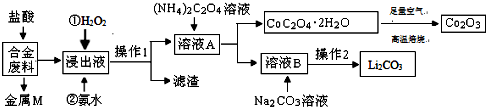
(1)金属M为Cu.
(2)加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水的作用是调节溶液的pH使Fe3+转化为Fe(OH)3沉淀.
(3)CoC2O4•2H2O高温焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失,90℃时Ksp(Li2CO3)的值为4.0×10-3.

(1)金属M为Cu.
(2)加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水的作用是调节溶液的pH使Fe3+转化为Fe(OH)3沉淀.
(3)CoC2O4•2H2O高温焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失,90℃时Ksp(Li2CO3)的值为4.0×10-3.
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
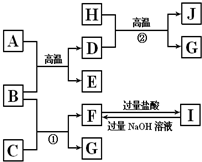 图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料.
图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料.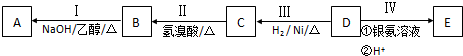
 ;
; ;
; 和
和 .
.