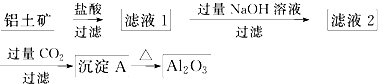
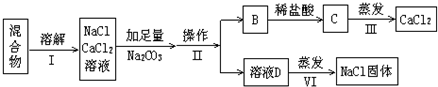
题目内容
已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定.硫酸亚铁在水中的溶解度为20.3(10℃)、26.3(20℃)、30.8(30℃)、40.1(40℃)….以下是将绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图.根据如图回答:
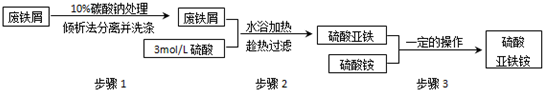
(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因: .
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有 :
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2中铁屑过量的目的是(用离子方程式表示): .步骤2中溶液趁热过滤的原因是 .
(4)步骤3中,加入(NH4)2SO4固体后,应加热到溶液表面出现晶膜时,停止加热.需经过的实验操作包括: 、 、减压过滤(或抽滤)等得到较为干燥的晶体.
(5)制得的硫酸亚铁铵中常含有杂质离子Fe3+,检验方法是: .

(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因:
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2中铁屑过量的目的是(用离子方程式表示):
(4)步骤3中,加入(NH4)2SO4固体后,应加热到溶液表面出现晶膜时,停止加热.需经过的实验操作包括:
(5)制得的硫酸亚铁铵中常含有杂质离子Fe3+,检验方法是:
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验评价题
分析:用碳酸钠溶液可以处理铁屑表面的油污等杂质,得到的铁和硫酸反应可以生成硫酸亚铁盐溶液,绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体.
(1)Na2CO3溶液中CO32-水解使Na2CO3溶液呈碱性;
(2)沉淀的颗粒较大,静止后容易沉降至容器底部,常用倾析法分离;
(3)防止Fe2+被氧化为Fe3+,步骤2中溶液趁热过滤防止溶液冷却时,硫酸亚铁因析出而损失;
(4)步骤3中,加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体;
(5)根据铁离子和硫氰酸钾之间能反生络合反应得到血红色物质来检验.
(1)Na2CO3溶液中CO32-水解使Na2CO3溶液呈碱性;
(2)沉淀的颗粒较大,静止后容易沉降至容器底部,常用倾析法分离;
(3)防止Fe2+被氧化为Fe3+,步骤2中溶液趁热过滤防止溶液冷却时,硫酸亚铁因析出而损失;
(4)步骤3中,加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体;
(5)根据铁离子和硫氰酸钾之间能反生络合反应得到血红色物质来检验.
解答:
解:用碳酸钠溶液可以处理铁屑表面的油污等杂质,得到的铁和硫酸反应可以生成硫酸亚铁盐溶液,绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体.
(1)Na2CO3溶液中CO32-水解CO32-+H2O?HCO3-+OH-,使Na2CO3溶液呈碱性.
故答案为:CO32-+H2O?HCO3-+OH-.
2)沉淀的颗粒较大,静止后容易沉降至容器底部,常用倾析法分离.沉淀呈胶状或絮状,静止后不容易沉降,不能采取倾析法分离.
故选:AB.
(3)Fe2+易被氧化为Fe3+,氧化的Fe3+与Fe发生反应Fe+2Fe3+=3Fe2+,防止Fe2+被氧化为Fe3+.
步骤2中溶液趁热过滤防止溶液冷却时,硫酸亚铁因析出而损失.
故答案为:Fe+2Fe3+=3Fe2+;防止溶液冷却时,硫酸亚铁因析出而损失.
(4)步骤3中,加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体.
故答案为:蒸发浓缩、冷却结晶.
(5)铁离子和硫氰酸钾之间能反生络合反应得到血红色物质,可以用硫氰酸钾检验铁离子,操作是:取少量制得的硫酸亚铁铵于试管中,加入适量的蒸馏水溶解,滴加1~2滴KSCN溶液,若溶液变血红色,则含Fe3+,
故答案为:取少量制得的硫酸亚铁铵于试管中,加入适量的蒸馏水溶解,滴加1~2滴KSCN溶液,若溶液变血红色,则含Fe3+.
(1)Na2CO3溶液中CO32-水解CO32-+H2O?HCO3-+OH-,使Na2CO3溶液呈碱性.
故答案为:CO32-+H2O?HCO3-+OH-.
2)沉淀的颗粒较大,静止后容易沉降至容器底部,常用倾析法分离.沉淀呈胶状或絮状,静止后不容易沉降,不能采取倾析法分离.
故选:AB.
(3)Fe2+易被氧化为Fe3+,氧化的Fe3+与Fe发生反应Fe+2Fe3+=3Fe2+,防止Fe2+被氧化为Fe3+.
步骤2中溶液趁热过滤防止溶液冷却时,硫酸亚铁因析出而损失.
故答案为:Fe+2Fe3+=3Fe2+;防止溶液冷却时,硫酸亚铁因析出而损失.
(4)步骤3中,加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体.
故答案为:蒸发浓缩、冷却结晶.
(5)铁离子和硫氰酸钾之间能反生络合反应得到血红色物质,可以用硫氰酸钾检验铁离子,操作是:取少量制得的硫酸亚铁铵于试管中,加入适量的蒸馏水溶解,滴加1~2滴KSCN溶液,若溶液变血红色,则含Fe3+,
故答案为:取少量制得的硫酸亚铁铵于试管中,加入适量的蒸馏水溶解,滴加1~2滴KSCN溶液,若溶液变血红色,则含Fe3+.
点评:本题以莫尔盐的制备为载体,考察盐类水解、氧化还原反应、氧化还原反应滴定应用、物质分离提纯等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目有一定的难度,注意基础知识的全面掌握.

练习册系列答案
相关题目
下列物质中,属于非是电解质的是( )
| A、熟石灰 |
| B、水 |
| C、O2 |
| D、NH3 |
天然碱的组成可以用aNa2CO3?bNaHCO3?cH2O(a、b、c为整数)表示.通过以下实验测定某天然碱的化学式,将质量为12.45g的某天然碱溶于水,逐滴滴加某浓度的稀盐酸,产生气体的体积与加入盐酸的体积(标准状况)的关系如下表所示:下列说法错误的是( )
| 盐酸体积(mL) | 20 | 40 | 60 | 80 |
| 产生气体体积(mL) | 0 | 560 | 1680 | 2520 |
| A、加入盐酸体积小于20 mL时,体系发生的离子反应为:CO32-+H+═HCO3- |
| B、加入盐酸体积为50 mL时,产生气体(标准状况)的体积为1120mL |
| C、本实验使用盐酸的浓度为2.5 mol?L-1 |
| D、该天然碱的化学式为Na2CO3?2NaHCO3?2H2O |
美国科学家最近发明了利用眼泪来检测糖尿病的装置,其原理是用氯金酸钠(NaAuCl4)溶液与眼泪中的葡萄糖反应生成纳米金单质颗粒(直径为20nm~60nm).下列有关说法中错误的是( )
| A、检测时NaAuCl4发生氧化反应 |
| B、葡萄糖的结构简式为CH2OH(CHOH)4CHO |
| C、葡萄糖具有还原性 |
| D、纳米金颗粒分散在水中所得的分散系能产生丁达尔效应 |
下列有机物分子中,所有的原子不可能在同一平面上的是( )
| A、CH2=CH-C≡N |
| B、CH2=CF-CF=CH2 |
C、 |
D、 |
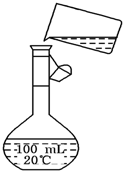 电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO
电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO