题目内容
9. (1)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸.按要求回答下列问题:
(1)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸.按要求回答下列问题:①电工操作上规定:不能把铜导线和铝导线连接在一起使用.请用电化学知识说明原因形成原电池加速铝导线的腐蚀.
②若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?能(填“能”或“不能”),若能,请写出电极反应式,负极:Cu-2e-=Cu2+;正极:2Fe3++2e-=2Fe2+.
③若用石墨作电极,电解1L0.1mol/L盐酸,当转移0.5mol电子时,阳极得到气体的体积(标况)为3.36L.
(2)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
①写出氢氧燃料电池工作时正极电极反应方程式:O2+2H2O+4e-=4OH-.
②如果该氢氧燃料电池每转移0.1mol电子,消耗标准状况下氧气0.56L.
③若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为CH4+10OH--8e-═CO32-+7H2O.
分析 (1)①铝和铜与合适的电解质溶液构成原电池;
②Cu、C和硫酸铁溶液构成原电池,铜易失电子发生氧化反应而作负极,碳作正极,正极上铁离子得电子发生还原反应;
③根据电解池的工作原理结合电极反应和电子守恒来计算即可;
(2)①写出氢氧燃料电池工作时正极是氧气放电,生成氢氧根离子,正极电极反应方程式:O2+2H2O+4e-=4OH-;
②消耗1mol的氧气转移,4mol电子,所以每转移0.1mol电子,消耗氧气的物质的量为:$\frac{0.1}{4}$mol=0.025mol;
③甲烷和氧气为原料进行工作时,负极甲烷发生氧化反应,碱性条件下,甲烷燃烧生成碳酸根离子.
解答 解:(1)①铜、铝的金属活泼性不同,遇到合适的电解质溶液易构成原电池,从而加快铝的腐蚀,所以不能把铜导线和铝导线连接在一起使用,
故答案为:形成原电池加速铝导线的腐蚀;
②铜、石墨的活泼性不同且都导电,铜和硫酸铁能自发的进行氧化还原反应,所以铜、石墨、硫酸铁溶液能构成原电池,铜易失去电子发生氧化反应,所以铜作负极,石墨作正极,负极上的电极反应式为:Cu-2e-=Cu2+,正极上铁离子得电子发生还原反应,电极反应式为2Fe3++2e-=2Fe2+,
故答案为:能;负极:Cu-2e-=Cu2+;正极:2Fe3++2e-=2Fe2+;
③若用石墨作电极,电解1L0.1mol/L盐酸,阳极上的反应2Cl--2e-=Cl2↑,4OH--4e-=O2↑+2H2O,阴极上的电极反应为:2H++2e-=H2↑,全部氯离子失电子总量是0.1mol生成氯气是0.05mol,失去0.4mol电子得到氧气的物质的量是0.1mol,当转移0.5mol电子时,阳极得到气体是氯气0.05mol,氧气0.1mol,所以当转移0.5mol电子时,阳极得到气体的体积(标况)为0.15mol×22.4L/mol=3.36L,故答案为:3.36;
(2)①写出氢氧燃料电池工作时正极是氧气放电,生成氢氧根离子,正极电极反应方程式:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②消耗1mol的氧气转移,4mol电子,所以每转移0.1mol电子,消耗氧气的物质的量为:$\frac{0.1}{4}$mol=0.025mol,所以体积为:0.025mol×22.4L/mol=0.56L,故答案为:0.56L;
③甲烷和氧气为原料进行工作时,负极甲烷发生氧化反应,碱性条件下,甲烷燃烧生成碳酸根离子,其电极反应式为:CH4+10OH--8e-═CO32-+7H2O;故答案为:CH4+10OH--8e-═CO32-+7H2O.
点评 本题考查学生原电池和电解池的工作原理知识,注意知识的归纳和整理以及电池的设计原理,难度不大.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案I.如图1,用浓HNO3,和过量的废铜屑充分反应制硝酸铜溶液.
(1)写出铜与浓硝酸反应的离子方程式Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(2)①装置中NaOH溶液的作用是吸收氮氧化物,防止污染空气.
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤是蒸发浓缩、冷却结晶、过滤.
③你认为此装置是否合理,并说明原因不合理,密闭体系中立即产生大量气体,会有安全隐患;或者合理,慢慢挤压,胶头滴管控制反应速率,使NaOH溶液及时吸收NO2.
如果不合理,同时在原装置上改进;如果合理,只需说明原因.
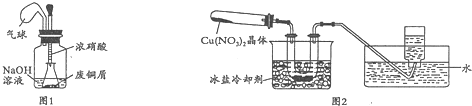
Ⅱ.为了探究Cu(NO3)2的热稳定性,探究小组按图2装置进行实验.(图中铁架台、铁夹和加热仪器均略去)
【实验装置】
【实验操作及现象】往试管中放入研细的无水Cu(NO3)2晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;用U型管除去红棕色气体,在集气瓶中收集到无色气体.
【解释与结论】
(3)①红棕色气体是NO2.
②根据现象判断Cu(NO3)2在加热条件下可以分解,其化学反应方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
Ⅲ.利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3•Cu(OH)2].
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4mol•L-1的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品.
【实验数据】反应温度对样品的影响
| 实验序号 | 1 | 2 | 3 | 4 |
| 温度/℃ | 35 | 50 | 70 | 95 |
| 样品颜色 | 深蓝色 | 深蓝色 | 浅绿色 | 暗蓝色 |
| 样品中碱式碳酸铜的质量分数/% | 90.9 | 92.7 | x | 92.0 |
(5)95℃时,样品颜色发暗的原因:含有黑色的氧化铜.
(6)70℃时,实验得到2.38g样品,取此样品加热至分解完全(杂质不分解),得到1.76g固体,此样品中碱式碳酸铜的质量分数是93.3%.
| A. | 萃取碘水中的碘时,将碘水倒入分液漏斗,然后再注入酒精,震荡静置后下层液体下口出,上层液体上口出 | |
| B. | 在蔗糖溶液中加入几滴稀硫酸,水浴加热5 min,加入NaOH溶液至碱性,再加入银氨溶液并水浴加热 | |
| C. | 将Fe(NO3)2固体溶于稀硫酸后,滴加KSCN溶液,溶液变红,说明已经Fe(NO3)2变质 | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤干燥 |
| A. | 医疗上常用75%的酒精杀菌消毒 | |
| B. | 由于分子间氢键的存在,NH3易液化,H2O常温下呈液态 | |
| C. | 雾霾公益调查纪录片《穹顶之下》的发布引起了人们的关注,雾霾属于胶体 | |
| D. | 氢气是理想的绿色能源,贮氢合金的发现和应用解决了氢气贮存运输的难题,贮氢金属与氢气发生化学反应,形成氢化物,达到贮存氢气的目的 |
| A. | 是否能形成丁达尔效应是胶体和溶液最本质的区别 | |
| B. | 胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 | |
| C. | “雨后彩虹”“海市蜃楼”既是一种自然现象又是光学现象,也与胶体的知识有关 | |
| D. | 除去Fe(OH)3胶体中的FeCl3,可将混合物装入半透膜中,放入蒸馏水里 |
| A. | 酸性氧化物 | B. | 碱性氧化物 | C. | 含氧酸 | D. | 非金属单质 |
 2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多.
2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多. .
. 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.