题目内容
9.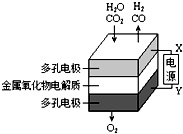 在固态金属氧化物电解池中,高温共电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2- | |
| C. | 总反应可表示为:H2O+CO2═H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是2:1 |
分析 A.电解池阳极发生氧化反应,阴极发生还原反应,根据与X极相连的电极产生的气体判断;
B.电解池阴极发生还原反应,根据反应物结合化合价的变化分析;
C.根据图示以及电解的目的解答;
D.根据图示知:阴极产生H2、CO,阳极产生氧气,结合C总的反应分析.
解答 解:A.根据图示知:与X相连的电极产生CO,电解H2O-CO2混合气体,二氧化碳得到电子生成一氧化碳,发生还原反应,电解池阴极发生还原反应,所以X是电源的负极,故A正确;
B.电解池阴极发生还原反应,电解H2O-CO2混合气体制备H2和CO,阴极:水中的氢原子得到电子生成氢气,H2O+2e-═H2↑+O2-,二氧化碳得到电子生成一氧化碳,CO2+2e-═CO+O2-,故B错误;
C.电解H2O-CO2混合气体制备H2和CO,根据图示知:阴极产生H2、CO,阳极产生氧气,所以总反应为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2,故C正确;
D.电解H2O-CO2混合气体制备H2和CO,总反应为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2,阴极产生H2、CO,阳极产生氧气,阴、阳两极生成的气体的物质的量之比是2:1,故D正确;
故选B.
点评 本题考查电解知识,侧重于考查学生的综合运用能力,题目难度中等,注意基础知识的积累掌握,掌握电解池阳极发生氧化反应,阴极发生还原反应为解答关键.

练习册系列答案
相关题目
19.已知:相同的两种元素组成的四种微粒A、B、C、D的质子数依次增多,A、B、C、D的电子数如表(A、B、C、D有两组可能),且D中的电子数等于质子数,D1可作医用消毒液. 其中B1的沸点比B2高.
试回答下列问题:
(1)如表两组八种微粒的组成元素中,非金属性最强的元素在元素周期表的位置是第二周期第VI族;
(2)液态的B2与Na反应类似于B1与Na反应,写出液态的B2与Na反应的化学方程式:2Na+2NH3(l)=2NaNH2+H2↑.
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备化学反应方程式2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,其中D1的作用是还原剂.
②利用①中原理制备出NaClO2•3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与Iˉ发生反应的氧化性杂质)的纯度,过程如图(已知:I2+2S2O32ˉ═S4O62ˉ+2Iˉ):
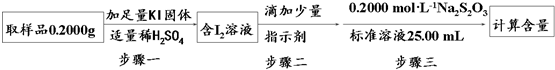
步骤一的离子方程式为ClO2-+4I-+4H+=2I2+Cl-+2H2O;步骤二的指示剂是淀粉;步骤三中出现溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点;计算该试样中NaClO2•3H2O的质量百分数为90.3%.(保留小数点后一位)
| ① | A1 | B1 | C1 | D1 |
| 电子数 | 10 | 10 | 10 | 18 |
| ② | A2 | B2 | C2 | D2 |
| 电子数 | 10 | 10 | 10 | 18 |
(1)如表两组八种微粒的组成元素中,非金属性最强的元素在元素周期表的位置是第二周期第VI族;
(2)液态的B2与Na反应类似于B1与Na反应,写出液态的B2与Na反应的化学方程式:2Na+2NH3(l)=2NaNH2+H2↑.
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备化学反应方程式2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,其中D1的作用是还原剂.
②利用①中原理制备出NaClO2•3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与Iˉ发生反应的氧化性杂质)的纯度,过程如图(已知:I2+2S2O32ˉ═S4O62ˉ+2Iˉ):

步骤一的离子方程式为ClO2-+4I-+4H+=2I2+Cl-+2H2O;步骤二的指示剂是淀粉;步骤三中出现溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点;计算该试样中NaClO2•3H2O的质量百分数为90.3%.(保留小数点后一位)
4.化学与生产、生活密切相关.下列叙述错误的是( )
| A. | 中国古代利用明矾的溶液的酸性清除铜镜表面的铜锈 | |
| B. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 | |
| C. | 14C可用于文物年代的鉴定,14C与12C互为同位素 | |
| D. | 喝补铁剂时,加服维生素C效果更好,原因是维生素C具有还原性 |
14.已知:△G=△H-T△S,△H为焓变,T为热力学温度,△S熵变,当△G<0时反应能自发进行,△G>0时反应不能自发进行,据此,下列吸热反应中,在高温下不能自发进行的是( )
| A. | CO(g)═C(s)+$\frac{1}{2}$O2(g) | B. | 2N2O5(g)═4NO2(g)+O2(g) | ||
| C. | (NH4)2CO3(s)═NH4HCO3(s)+NH3(g) | D. | MgCO3(s)═MgO(s)+CO2(g) |
1.下列叙述正确的是( )
| A. | 阳离子只能得到电子被还原,作氧化剂 | |
| B. | 在金属活性顺序表中,Na排在Cu的前面,所以Na可与CuSO4溶液反应置换出单质Cu | |
| C. | 在氧化还原反应中,不一定所有元素的化合价都发生变化 | |
| D. | 氧化还原反应中,某元素由化合态变为游离态,此元素一定被还原 |
18.在无色透明强酸性溶液中,以下能大量共存的离子组是( )
| A. | K+、Cu2+、NO3-、CO32- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | Mg2+、NH4+、NO3-、CO32- | D. | NH4+、K+、OH-、SO42- |
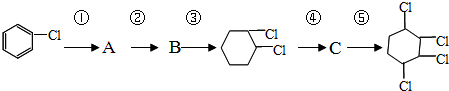
 、⑤
、⑤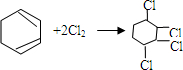 .
.
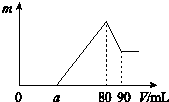 把一定质量的镁、铝混合物投入到2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.
把一定质量的镁、铝混合物投入到2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.