题目内容
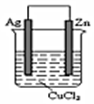
17.下列叙述正确的是( )| A. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 | |
| B. | 室温下向10mL pH=3的醋酸溶液中加水稀释后,溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)•c(O{H^-})}}$减小 | |
| C. | 室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol/L的NaF溶液与0.1 mol/L的CH3COOK溶液相比,一定有c(Na+)-c(F-)<c(K+)-c(CH3COO-)成立 | |
| D. | 在25℃时,将0.01 mol/L的氨水与0.01 mol/L的盐酸混合,充分反应后溶液中若c(NH4+)=c(Cl-),则氨水所用的体积一定大于盐酸的体积 |
分析 A、四氯化碳能萃取碘单质;
B、室温下向10mL pH=3的醋酸溶液中加水稀释后,促进醋酸的电离,但溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)•c(O{H^-})}}$=$\frac{{K}_{a}}{{K}_{w}}$,而水解平衡常数与电离平衡常数是温度的函数;
C、浓度相同的NaCN溶液与CH3COOK溶液中,分别存在电荷守恒为:c(Na+)+c(H+)=c(F-)+c(OH-),c(K+)+c(H+)=c(CH3COO-)+c(OH-),
则c(Na+)-c(F-)=c(OH-)-c(H+),c(K+)-c(CH3COO-)=c(OH-)-c(H+),NaF在溶液水解程度比CH3COOK小,则NaF中c(OH-)小,所以c(Na+)-c(F-)<c(K+)-c(CH3COO-);
D、将0.01mol•L-1的氨水与0.01mol•L-1的盐酸混合,若等体积混合时,得到的溶液是氯化铵,铵根离子水解显示酸性,即NH4++H2O?NH3•H2O+H+,溶液中存在电荷守恒关系:c(NH4+)+c(H+)=c(Cl-)+c(c(OH-),若反应后溶液中c(NH4+)=c(Cl-),则c(H+)=c(OH-),溶液呈中性,两者等体积生成氯化铵溶液呈酸,所以氨水所用的体积一定大于盐酸的体积.
解答 解:A、碘在四氯化碳中的溶解度大于在水中的溶解度,且四氯化碳和水不互溶,和碘不反应,所以四氯化碳能萃取碘,碘在四氯化碳中呈紫红色,向盛有KI3溶液的试管中加入适量的CCl4,振荡静置后CCl4层显紫红色,说明I2被四氯化碳萃取,故A错误;
B、室温下向10mL pH=3的醋酸溶液中加水稀释后,促进醋酸的电离,但溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)•c(O{H^-})}}$=$\frac{{K}_{a}}{{K}_{w}}$,而水解平衡常数与电离平衡常数是温度的函数,所以加水稀释溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)•c(O{H^-})}}$不变,故B错误;
C、浓度相同的NaCN溶液与CH3COOK溶液中,分别存在电荷守恒为:c(Na+)+c(H+)=c(F-)+c(OH-),c(K+)+c(H+)=c(CH3COO-)+c(OH-),
则c(Na+)-c(F-)=c(OH-)-c(H+),c(K+)-c(CH3COO-)=c(OH-)-c(H+),NaF在溶液水解程度比CH3COOK小,则NaF中c(OH-)小,所以c(Na+)-c(F-)<c(K+)-c(CH3COO-),故C正确;
D、将0.01mol•L-1的氨水与0.01mol•L-1的盐酸混合,若等体积混合时,得到的溶液是氯化铵,铵根离子水解显示酸性,即NH4++H2O?NH3•H2O+H+,溶液中存在电荷守恒关系:c(NH4+)+c(H+)=c(Cl-)+c(c(OH-),若反应后溶液中c(NH4+)=c(Cl-),则c(H+)=c(OH-),溶液呈中性,两者等体积生成氯化铵溶液呈酸,所以氨水所用的体积一定大于盐酸的体积,故D正确;
故选CD.
点评 本题考查了弱电解质的概念、弱电解质的电离、平衡常数的应用、盐的水解原理的应用、电荷守恒等,题目涉及的知识点较多,侧重于基础知识的综合应用的考查,题目难度中等.

| A. | 胶体区别于其他分散系的根本原因是胶体有丁达尔现象 | |
| B. | 分散系中分散质粒子直径由小到大的正确顺序是:溶液<浊液<胶体 | |
| C. | 有单质参加或有单质生成的反应一定是氧化还原反应 | |
| D. | 失电子的反应物在反应中作还原化剂,反应中被氧化 |
| A. |  | B. | CH3-CH2-CH2-CH2-CH3 | ||
| C. | 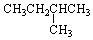 | D. |  |
| A. | SO2 | B. | H2O2 | C. | Cl2 | D. | 碘酒 |
| A. | NaH | B. | H2O | C. | CH4 | D. | HCl |
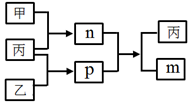 短周期主族元素A、B、C、D的原子序数依次增大,C和D位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在BD2中,p的水溶液是一种二元弱酸,有漂白性.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )
短周期主族元素A、B、C、D的原子序数依次增大,C和D位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在BD2中,p的水溶液是一种二元弱酸,有漂白性.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )| A. | 原子半径:A<B<C | |
| B. | BD2分子中所有原子都达到了8电子稳定结构 | |
| C. | C与D的简单氢化物沸点,后者高 | |
| D. | 非金属性:D>C>B |
| A. | Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+═SO42-+3S↓+H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ | |
| C. | 盐碱地(含较多NaCl、Na2CO3)中加入石膏,降低土壤的碱性,涉及的方程式为:Ca2++CO32-═CaCO3↓ | |
| D. | 向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O |
 在通电条件下,用如图所示装置由乙二醛(OHC-CHO)反应制备乙二酸(HOOC-COOH).其制备反应为:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl.下列说法正确的是( )
在通电条件下,用如图所示装置由乙二醛(OHC-CHO)反应制备乙二酸(HOOC-COOH).其制备反应为:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl.下列说法正确的是( )| A. | 每消耗0.lmol乙二醛,在Pt1极放出2.24L气体(标准状况) | |
| B. | Pt1的电极反应为:4OH--4e-=2H2O+O2↑ | |
| C. | 每得到1mol乙二酸将有2molH+从右室迁移到左室 | |
| D. | 盐酸是起提供Cl-和增强导电性的作用 |