题目内容
某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3?6H2O)的工艺,其设计的流程如图:

回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是 ;
(2)“酸溶”中反应的离子方程式是 ;
(3)“过滤”后滤液中金属阳离子有 ;
(4)“氧化”中使用的氧化剂最好是 .

回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是
(2)“酸溶”中反应的离子方程式是
(3)“过滤”后滤液中金属阳离子有
(4)“氧化”中使用的氧化剂最好是
考点:制备实验方案的设计
专题:实验设计题
分析:由以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体的流程可知,在焙烧时FeS2与氧气反应生成四氧化三铁和二氧化硫,然后四氧化三铁溶于盐酸生成氯化铁,过滤后滤液中加氧化剂氯气(或氯水等),除去混有的亚铁离子,最后结晶制备晶体,以此来解答.
解答:
解:由以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体的流程可知,在焙烧时FeS2与氧气反应生成四氧化三铁和二氧化硫,然后四氧化三铁溶于盐酸生成氯化铁,过滤后滤液中加氧化剂氯气(或氯水等),除去混有的亚铁离子,最后结晶制备晶体,
(1)焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是3FeS2+8O2
Fe3O4+6SO2,故答案为:3FeS2+8O2
Fe3O4+6SO2;
(2)“酸溶”中反应的离子方程式是Fe3O4+8H+=2Fe3++Fe2++4H2O,故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
(3)由(2)可知“过滤”后滤液中金属阳离子有Fe3+、Fe2+,故答案为:Fe3+、Fe2+;
(4)由(3)可知,氧化的目的是除去亚铁离子,且不引入新杂质,则“氧化”中使用的氧化剂最好是Cl2(或H2O2等),故答案为:Cl2(或H2O2等).
(1)焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是3FeS2+8O2
| ||
| ||
(2)“酸溶”中反应的离子方程式是Fe3O4+8H+=2Fe3++Fe2++4H2O,故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
(3)由(2)可知“过滤”后滤液中金属阳离子有Fe3+、Fe2+,故答案为:Fe3+、Fe2+;
(4)由(3)可知,氧化的目的是除去亚铁离子,且不引入新杂质,则“氧化”中使用的氧化剂最好是Cl2(或H2O2等),故答案为:Cl2(或H2O2等).
点评:本题考查制备实验方案的设计,为高频考点,把握制备流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应的分析,题目难度不大.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质H2C2O4?2H2O的称量以及用NaOH溶液滴定等操作.下列有关说法正确的是( )
A、 用图所示操作转移NaOH溶液到容量瓶中 |
B、 用图所示装置准确称得0.1575gH2C2O4?2H2O固体 |
C、 用 用图所示操作排除碱式滴定管中的气泡 |
D、 用图所示装置以NaOH待测液滴定H2C2O4溶液 |
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A、滴入石蕊试液显蓝色的溶液中:K+、Na-、HSO3-、ClO- |
| B、0.1mol?L-l的Fe(NO3)2溶液中:Na+、H+、SCN-、I- |
| C、0.1mol?L-l的NaAlO2溶液中:K+、H+、NO3-、SO42- |
| D、由水电离产生的c(H+)=1×10-13mol?L-l的溶液中:Na+、Ba2+、NO3-、Cl- |
下列有关说法中,正确的是( )
| A、光导纤维、聚酯纤维、棉花都属于有机高分子化合物 |
| B、在大米酿酒的过程中,淀粉最后变成了单糖 |
| C、“地沟油”经过加工处理后可以用来制肥皂 |
| D、明矾和漂白粉处理自来水,二者的作用原理相同 |
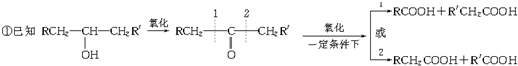
 甲醇、乙醇是重要的有机化工原料,有着重要的用途和应用前景.
甲醇、乙醇是重要的有机化工原料,有着重要的用途和应用前景. 乙烯酮(CH2=C=O)是一种重要的有机中间体,可由C2H2和O2的混合气体通过锌、钙、银的三种金属的氧化物(催化剂)反应得到.也可用CH3COOH在痕量(C2H5O)3P=O存在下加热脱H2O得到.
乙烯酮(CH2=C=O)是一种重要的有机中间体,可由C2H2和O2的混合气体通过锌、钙、银的三种金属的氧化物(催化剂)反应得到.也可用CH3COOH在痕量(C2H5O)3P=O存在下加热脱H2O得到.

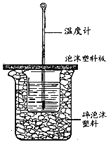 用如图所示装置进行中和热测定实验,请回答下列问题:
用如图所示装置进行中和热测定实验,请回答下列问题: