题目内容
10.下列有关说法中不正确的是( )| A. | 镀锌铁的镀层破损后,镀层仍然对铁起保护作用 | |
| B. | 根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液 | |
| C. | Cl2与SO2使品红溶液褪色的原理相同 | |
| D. | SiO2可用于制造光导纤维,其性质稳定,不溶于强酸,但是能溶于强碱 |
分析 A.Fe与Zn形成原电池时Fe作正极被保护;
B.根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液;
C.氯气和二氧化硫反应生成硫酸和盐酸,不具有漂白性;
D.二氧化硅是酸性氧化物,能和强碱反应生成盐和水.
解答 解:A.Fe与Zn形成原电池时Fe作正极被保护,所以镀锌铁的镀层破损后,镀层仍然对铁起保护作用,故A正确;
B.分散质微粒直径大小可以将分散系分为溶液、胶体和浊液,故B正确;
C.向品红溶液中同时通入Cl2、SO2,氯气和二氧化硫反应生成硫酸和盐酸,不具有漂白性,不能是品红褪色,故C错误;
D.SiO2可用于制造光导纤维,其性质稳定,能和强碱反应生成盐和水,故D正确;
故选:C.
点评 本题考查了元素化合物知识,熟悉原电池工作原理、氯气、二氧化硫、二氧化硅的性质是解题关键,题目难度中等.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
1.用如表实验方案及所选玻璃容器(非玻璃容器任选)能够实现相应实验目的是( )
| 实验目的 | 实验方案 | 所选玻璃仪器 | |
| A | 除去乙酸乙酯中少量乙醇 | 将混合物中加水,多次水洗分液 | 分液漏斗、烧杯 |
| B | 证明HClO和醋酸的酸性强弱 | 同温下用pH试纸测定浓度为0.1mol•L-1NaClO溶液和0.1mol•L-1CH3COONa溶液的pH | 玻璃棒、玻璃片 |
| C | 由FeCl3溶液得到FeCl3•6H2O晶体 | 向FeCl3溶液中不断滴加盐酸,加热,至有晶体 出现 | 酒精灯、表面皿、玻璃棒 |
| D | 配制1L 0.1mol•L-1的CuSO4溶液 | 将16gCuSO4•5H2O溶于水配成1000mL溶液 | 烧杯、量筒、玻璃棒、1000mL容量瓶 |
| A. | A | B. | B | C. | C | D. | D |
18. 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
氢氧化钠少量时2NH4HSO4+2NaOH═(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH═Na2SO4+NH3↑+2H2O
(1)同学们设计的实验装置图如图,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.
称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如表:
请计算(计算结果保留两位小数):
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:氢氧化钠少量时2NH4HSO4+2NaOH═(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH═Na2SO4+NH3↑+2H2O
(1)同学们设计的实验装置图如图,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.
称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如表:
| 氢氧化钠溶液体积/mL | 40.00mL | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.
5.下列有机化合物与其同分异构体数目一致的是(不考虑立体异构)( )
| 选项 | 有机化合物 | 同分异构体数目 |
| A | 分子式为C8H10的芳香烃 | 3种 |
| B | 分子式为C4H8的烯烃 | 2种 |
| C | 分子式为C6H12O2的羧酸 | 8种 |
| D | 分子式为C4H10O的醇 | 5种 |
| A. | A | B. | B | C. | C | D. | D |
2.如表实验中,对应的现象以及结论都正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将气体X通入品红溶液和酸性高锰酸钾溶液 | 两溶液均褪色 | X可能是乙烯 |
| B | 向淀粉溶液中加入稀H2SO4,水浴加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 表明淀粉没有水解生成葡萄糖 |
| C | 向含有Cl-和SO42-溶液中,加入过量的硝酸化的Ba(NO3)2溶液,过滤,向滤液中再滴加AgNO3溶液 | 有白色沉淀生成 | 证明溶液中有Cl- |
| D | 向盛有5mL0.005mol•L-1 FeCl3溶液的试管中加入5mL0.01mol•L 1KSCN溶液后,再加入4滴0.1mol•L -1KSCN溶液 | 溶液红色加深 | Fe3++3SCN-?Fe(SCN)3可逆反应 |
| A. | A | B. | B | C. | C | D. | D |
19.用如图实验装置进行相应实验.装置正确且能达到实验目的是( )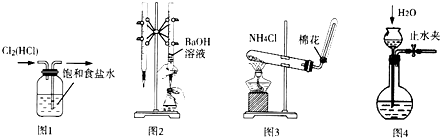

| A. | 用图l所示装置除去Cl2中的HCl杂质 | |
| B. | 用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 | |
| C. | 用图3所示装置实验室制取NH3 | |
| D. | 用图4所示装置检查装置气密性 |
 .
.