题目内容
4.下列除杂操作中,除杂所用的试剂正确的是( )| 被提纯的物质 | 杂质 | 除杂试剂 | |
| A | H2S | H2O | 无水CuSO4 |
| B | NH3 | H2O | 无水CuCl2 |
| C | SO2 | HCl | 饱和食盐水、浓硫酸 |
| D | CO2 | HCl | 饱和NaHCO3溶液、浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.无水CuSO4可检验水,且CuSO4与H2S反应;
B.无水CuCl2不能吸收水,且与氨气发生反应;
C.SO2可溶于食盐水;
D.HCl与饱和碳酸氢钠溶液反应生成二氧化碳.
解答 解:A.无水CuSO4可检验水,且CuSO4与H2S反应,不能除杂,故A不选;
B.无水CuCl2不能吸收水,且与氨气发生反应,不能除杂,故B不选;
C.SO2可溶于食盐水,应选饱和亚硫酸氢钠溶液、浓硫酸,故C不选;
D.HCl与饱和碳酸氢钠溶液反应生成二氧化碳,再利用浓硫酸干燥可除杂,故D选;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应及混合物分离方法为解答本题的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
5.将铁粉和铜粉的均匀混合物,平均分为四等分,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量表如表(设硝酸的还原产物只有NO)
试计算:
(1)硝酸的浓度.
(2)每份金属混合物的总质量.
(3)实验④中V的值.
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/ml | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L | 2.24L | 4.48L | 6.7L | V |
(1)硝酸的浓度.
(2)每份金属混合物的总质量.
(3)实验④中V的值.
12.由乙醇及必要的无机试剂合成乙二醇,其依次发生的反应类型为( )
| A. | 取代,消去,加成 | B. | 加成,消去,取代 | C. | 消去,加成,取代 | D. | 取代,加成,消去 |
19.当氯气用于漂白时,真正起漂白作用的是( )
| A. | Cl- | B. | HClO | C. | HCl | D. | Cl2 |
9.除去下列各组物质中的杂质,所用试剂不适当的是( )
| A. | Fe粉中混有Cu粉杂质--稀硫酸 | B. | FeCl3溶液中混有FeCl2杂质--Cl2 | ||
| C. | Cu粉中混有CuO杂质--H2 | D. | FeCl2溶液中混有FeCl3杂质--Cu |
13.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
(1)B元素处于元素周期表中三周期ⅢA族;
(2)在元素周期表中金属与非金属的分界处,可以找到制半导体材料的元素;
(3)上述五种元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式);
(4)C、E形成的化合物为SO2、SO3(填化学式).
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(2)在元素周期表中金属与非金属的分界处,可以找到制半导体材料的元素;
(3)上述五种元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式);
(4)C、E形成的化合物为SO2、SO3(填化学式).
14.下列说法中,正确的是( )
| A. | 甲醛、乙醛、丙醛都没有同分异构体 | |
| B. | 已知甲醛是平面型分子,则苯甲醛的所有原子有可能在同一平面上 | |
| C. | 甲醛、乙醛、苯甲醛都能发生加成、氧化和酯化反应 | |
| D. | 可用新制的Cu(OH)2来区分甲醛和苯甲醛 |
 ,HCN中C的化合价为-2.
,HCN中C的化合价为-2.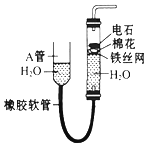 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空: