题目内容
在恒温恒压条件下,在密闭的容器中发生反应,3H2+N2?2NH3,到达平衡时,测得N2、H2、NH3分别为5mol、2mol、2mol,容器的体积为10L,现往容器中再通入N21.8mol,平衡将( )
| A、向右移动 | B、向左移动 |
| C、不移动 | D、无法判断 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:先依据题干条件计算 平衡浓度,结合平衡常数概念计算,加入氮气后加水此时的浓度商和平衡常数比较判断反应进行的方向;
解答:
解:在恒温恒压条件下,在密闭的容器中发生反应,3H2+N2?2NH3,到达平衡时,测得N2、H2、NH3分别为5mol、2mol、2mol,容器的体积为10L,此时平衡常数K=
=10,现往容器中再通入N21.8mol,恒压容器中气体物质的量之比等于体积之比,9:10=(9+1.8):V,此时气体体积V=12L,此时Q=
=10.6>K=10平衡将逆向进行;
故选B.
| 0.22 |
| 0.5×0.23 |
(
| ||||
|
故选B.
点评:本题考查了化学平衡常数计算和影响平衡的因素,掌握基础注意恒压容器体积分数变化分析判断,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某混合溶液中所含离子的浓度如下表,则M离子可能为( )
| 所含离子 | Cl- | SO42- | H+ | M |
| 浓度/(mol?L-1) | 2 | 1 | 2 | 1 |
| A、Na+ |
| B、Ba2+ |
| C、NO3- |
| D、Mg2+ |
能用H++OH-=H2O来表示的化学反应是( )
| A、固体Cu(OH)2和H2SO4溶液反应 |
| B、Ba(OH)2溶液和H2SO4溶液反应 |
| C、KOH溶液和醋酸溶液反应 |
| D、澄清石灰水和HNO3溶液反应 |
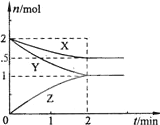 在容器固定的2L密闭容器中,一定条件下,发生如下反应X(g)+2Y(g)?n Z(g),反应过程中各物质的物质的量与时间的关系如图所示,则下列有关叙述中正确的是( )
在容器固定的2L密闭容器中,一定条件下,发生如下反应X(g)+2Y(g)?n Z(g),反应过程中各物质的物质的量与时间的关系如图所示,则下列有关叙述中正确的是( )①n=1 ②n=2 ③反应开始至2min时,Y的转化率为50% ④反应开始至平衡时,Vx=0.75mol?L-1?min-1 ⑤X的平衡浓度为0.75mol?L-1 ⑥达平衡时容器内的压强是开始时的0.875倍.
| A、②③⑤⑥ | B、②④⑤ |
| C、②③④⑥ | D、①③④⑥ |
关于物质的类别或成分,下列说法正确的是( )
| A、食盐水、糖水和冰水都是饮料,故都属于混合物 |
| B、盐酸、硫酸、硝酸、NaHSO4都能电离出氢离子,故都属于化合物中的酸 |
| C、石灰水的主要成分是CaO,石灰石的主要成分是CaCO3 |
| D、烧碱属于碱,纯碱属于盐 |
下列物质能发生消去反应的是( )
| A、CH3I |
| B、CH3OH |
| C、(CH3)3COH |
| D、(CH3)3C-CH2C1 |
下列图示的装置可以构成原电池的是( )
A、 |
B、 |
C、 |
D、 |
下列反应的离子方程式正确的是( )
| A、澄清石灰水跟盐酸反应:OH-+H+=H2O |
| B、金属钠跟水反应:Na+2H2O=Na++2OH-+H2↑ |
| C、碳酸钡与醋酸反应:BaCO3+2H+=CO2↑+Ba2++H2O |
| D、碳酸氢钠溶液和氢氧化钠溶液反应:HCO3-+OH-=CO2↑+H2O |