题目内容
12.在60g碳中,所有碳原子的质子的总数约为30NA 个.分析 先根据质量求出物质的量,然后结合1个碳原子质子数为6进行计算.
解答 解:60g碳的物质的量为$\frac{60g}{12g/mol}$=5mol,所含碳原子质子的总数目为5mol×6×NA/mol=30NA,
故答案为:30NA.
点评 本题考查原子中质子数与物质的量的相关计算,侧重于原子结构的考查,题目难度不大.

练习册系列答案
相关题目
6.以石化产品乙烯、丙烯为原料合成厌氧胶的流程如图.

关于该过程的相关叙述正确的是( )

关于该过程的相关叙述正确的是( )
| A. | 反应④的反应类型是加聚 | B. | 物质A含有两种官能团 | ||
| C. | 物质B催化氧化后可以得到乙醛 | D. | 1mol物质D最多可以消耗2molNaOH |
3.如图1,科学研究表明,当前应用最广泛的化石燃料到本世纪中叶将枯竭,解决此危机的唯一途径是实现燃料和燃烧产物之间的良性循环:
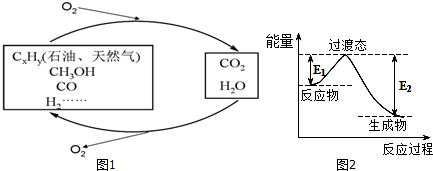
(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2转化为甲醇蒸汽和水蒸气.图2是生成1molCH3OH时的能量变化示意图.
已知破坏1mol不同共价键的能量(kJ)分别是:
已知E1=8.2kJ•mol-1,则E2=198.8kJ•mol-1.
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的△H<0(填“<”或“>”).
②实验2条件下的平衡常数K=$\frac{1}{3}$.
③实验3中,若平衡时H2O的转化率为25%,则$\frac{a}{b}$=0.5.
④实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时V正<V逆(填“<”或“>”或“=”).
(3)捕捉CO2可以利用Na2CO3溶液.先用Na2CO3溶液吸收CO2生成NaHCO3,然后使NaHCO3分解,Na2CO3可以进行循环使用.将100mL 0.1mol/LNa2CO3的溶液中通入112mL(已换算为标准状况)的CO2,溶液中没有晶体析出,则:
①反应后溶液中的各离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②反应后的溶液可以作“缓冲液”(当往溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用),请解释其原理反应后的溶液存在HCO3-?CO32-+H+,加入少量的酸,平衡逆向移动,溶液pH变化不大;加入少量的碱平衡正向移动,溶液pH变化也不大,故该溶液可以作“缓冲液”.

(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2转化为甲醇蒸汽和水蒸气.图2是生成1molCH3OH时的能量变化示意图.
已知破坏1mol不同共价键的能量(kJ)分别是:
| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验 | 温度/℃ | 起始量] | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | 25% | 3 | |
| 3 | 900 | a | b | c | t | |
②实验2条件下的平衡常数K=$\frac{1}{3}$.
③实验3中,若平衡时H2O的转化率为25%,则$\frac{a}{b}$=0.5.
④实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时V正<V逆(填“<”或“>”或“=”).
(3)捕捉CO2可以利用Na2CO3溶液.先用Na2CO3溶液吸收CO2生成NaHCO3,然后使NaHCO3分解,Na2CO3可以进行循环使用.将100mL 0.1mol/LNa2CO3的溶液中通入112mL(已换算为标准状况)的CO2,溶液中没有晶体析出,则:
①反应后溶液中的各离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②反应后的溶液可以作“缓冲液”(当往溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用),请解释其原理反应后的溶液存在HCO3-?CO32-+H+,加入少量的酸,平衡逆向移动,溶液pH变化不大;加入少量的碱平衡正向移动,溶液pH变化也不大,故该溶液可以作“缓冲液”.
20.一定温度、压强下,若一个氦原子实际质量是b g,12C的原子实际质量是a g,氦气的密度为ρ g/cm3,该温度压强下氦气的摩尔体积为Vm L/mol,NA是阿伏加德罗常数的值,下列说法正确的是( )
| A. | 氦原子的相对原子质量是$\frac{12a}{b}$ | B. | 氦气的摩尔质量是(ρVm) g/mol | ||
| C. | m g氦气所含质子数是$\frac{2m}{b}$ | D. | m g氦气的物质的量是$\frac{m}{(b{N}_{A})}$ |
7.下列陈述Ⅰ和Ⅱ均正确,并存在因果关系的是( )
| 陈述Ⅰ | 陈述Ⅱ | |
| A | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| B | 非金属性:Cl>S | 酸性:HClO3>H2SO4 |
| C | 常温下,NaHCO3的溶解度比Na2CO3小 | 向饱和Na2CO3溶液中通入CO2产生沉淀 |
| D | 常温下,SO2与氢硫酸和NaOH溶液均可反应 | SO2是两性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
1.下列对对应现象的描述与离子方程式都正确的是( )
| A. | 金属镁与稀盐酸反应:有气体生成,Mg+2 H++2Cl-═MgCl2+H2↑ | |
| B. | 氯化钡溶液与硫酸反应:有白色沉淀生成:SO42-+Ba2+═BaSO4↓ | |
| C. | 碳酸钠溶液与盐酸反应:有气泡逸出:Na2CO3+2 H+═2Na++CO2↑+H2O | |
| D. | 过量铁粉与氯化铜溶液反应:溶液由蓝色变成浅绿色,同时有红色固体生成:Fe+Cu2+═Fe3++Cu |
2.近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574 kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ/mol
③H2O(g)═H2O(l)△H=-44.0 kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式:2CH4(g)+4NO2(g)═2N2(g)+2CO2(g)+4H2O(l)△H=-1910kJ/mol.
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=akJ•mol-1.
在T1℃时,反应进行到不同时间测得各物质的浓度如表:
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率V(NO)=0.042mol•L-1•min-1;计算该反应的平衡常数K=;
②30min后,只改变某一条件,根据上表中的数据判断改变的条件可能是BE(填字母编号).
A.通人一定量的CO2 B.加入合适的催化剂 C.适当缩小容器的体积
D.通人一定量的NO E.加入一定量的活性炭
③若50min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率降低(填“升高”或“降低”),a< 0(填“>”或“<”).
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574 kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ/mol
③H2O(g)═H2O(l)△H=-44.0 kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式:2CH4(g)+4NO2(g)═2N2(g)+2CO2(g)+4H2O(l)△H=-1910kJ/mol.
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=akJ•mol-1.
在T1℃时,反应进行到不同时间测得各物质的浓度如表:
 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,根据上表中的数据判断改变的条件可能是BE(填字母编号).
A.通人一定量的CO2 B.加入合适的催化剂 C.适当缩小容器的体积
D.通人一定量的NO E.加入一定量的活性炭
③若50min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率降低(填“升高”或“降低”),a< 0(填“>”或“<”).