题目内容
4.将铁棒和锌棒用导线连接插入CuSO4溶液里,当电池中有0.2mol电子通过时,负极质量的变化是( )| A. | 增加6.5 g | B. | 减少6.5 g | C. | 减少5.6 g | D. | 增加6.4 g |
分析 铁棒、锌棒和硫酸铜溶液形成的原电池中,较活泼的金属锌棒作负极,铁棒作正极,负极上锌失电子变成锌离子进入溶液,所以负极质量会减少,正极上铜离子得电子生成铜单质,所以正极上铁棒质量会增加,根据电极方程式 Zn-2e-=Zn2+和转移电子的关系计算即可.
解答 解:铁棒、锌棒和硫酸铜溶液形成的原电池中,较活泼的金属锌棒作负极,铁棒作正极,负极上锌失电子质量减少,正极上铜离子得电子质量增加.
设负极上质量减少x.
负极上的电极反应式为:
Zn-2e-=Zn2+,
65g 2mol
x 0.2mol
x=$\frac{65g×0.2mol}{2mol}$=6.5g,
所以负极质量减少6.5g,
故选B.
点评 本题考查原电池工作原理,题目难度不大,明确正负极上发生的反应是解本题的关键,然后根据金属质量和转移电子之间的关系计算即可.

练习册系列答案
相关题目
14.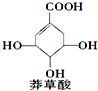 莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
 莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )| A. | 分子中含有2种官能团 | |
| B. | 在水溶液中羧基和羟基均能电离出H+ | |
| C. | 分子式为C7H6O5 | |
| D. | 可发生加成和取代反应 |
15.已知如下反应:
 在水溶液中存在平衡:
在水溶液中存在平衡: 当
当 与 CH3CH2OH发生酯化反应时,不可能生成的产物是( )
与 CH3CH2OH发生酯化反应时,不可能生成的产物是( )
 在水溶液中存在平衡:
在水溶液中存在平衡: 当
当 与 CH3CH2OH发生酯化反应时,不可能生成的产物是( )
与 CH3CH2OH发生酯化反应时,不可能生成的产物是( )| A. |  | B. |  | C. | H2O | D. | H218O |
12.石油炼制过程中,既能提高汽油产量又能提高汽油质量的方法是( )
| A. | 分馏 | B. | 裂解 | C. | 催化裂化 | D. | 萃取 |
19.下列叙述中错误的是( )
| A. | 还原性:Na>Mg>Al>Fe | B. | 碱性:NaOH>KOH>Ca(OH)2 | ||
| C. | 稳定性:HF>HCl>HBr>HI | D. | 酸性:HClO4>H2SO4>CH3COOH>H2CO3 |
16.由苯作原料不能经一步化学反应制得的是( )
| A. | 硝基苯 | B. | 环己烷 | C. | 苯酚 | D. | 溴苯 |
14.下列有机化合物中均含有杂质,除去这些杂质的方法中正确的是( )
| A. | 苯中含苯酚杂质:加入溴水,过滤 | |
| B. | 乙烷中含乙烯杂质:通入酸性高锰酸钾溶液,洗气 | |
| C. | 乙醇中含乙酸杂质:加入氢氧化钠溶液洗涤,分液 | |
| D. | 乙酸丁酯中含乙酸杂质:加入饱和碳酸钠溶液洗涤,分液 |
