题目内容
黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸的主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
【实验一】测定硫元素的含量.
Ⅰ.将m1 g黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,往甲瓶中不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.石英管中主要发生反应的化学方程式为:4FeS2+11O2
2Fe2O3+8SO2.

Ⅱ.反应结束后,将乙瓶中的溶液按图2的流程进行处理(H2O2可以氧化亚硫酸钠).

【实验二】测定铁元素的含量.
Ⅲ.测定铁元素含量的实验步骤如图3所示(假设其他金属元素不影响铁元素的测定;MnO4-在酸性条件下可将Fe2+氧化成Fe3+,并被还原为Mn2+).

问题讨论:
(1)图2装置中,甲瓶内所盛试剂是 溶液.
(2)图3流程中除了可以用H2O2溶液作为氧化剂,还可用 (填序号)为氧化剂.
①氯水 ②浓硫酸 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为 (用含字母的式子表示).
(4)写出在酸性溶液中,KMnO4与Fe2+反应的离子方程式 .
(5)列式计算黄铁矿样品中铁元素的质量(没有计算过程;计算结果正确也不给分) .
(6)有同学认为用上述方法所测定的铁元素的含量比实际含量偏大(上述实验操作、计算均正确),其原因是 .
【实验一】测定硫元素的含量.
Ⅰ.将m1 g黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,往甲瓶中不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.石英管中主要发生反应的化学方程式为:4FeS2+11O2
| ||

Ⅱ.反应结束后,将乙瓶中的溶液按图2的流程进行处理(H2O2可以氧化亚硫酸钠).

【实验二】测定铁元素的含量.
Ⅲ.测定铁元素含量的实验步骤如图3所示(假设其他金属元素不影响铁元素的测定;MnO4-在酸性条件下可将Fe2+氧化成Fe3+,并被还原为Mn2+).

问题讨论:
(1)图2装置中,甲瓶内所盛试剂是
(2)图3流程中除了可以用H2O2溶液作为氧化剂,还可用
①氯水 ②浓硫酸 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为
(4)写出在酸性溶液中,KMnO4与Fe2+反应的离子方程式
(5)列式计算黄铁矿样品中铁元素的质量(没有计算过程;计算结果正确也不给分)
(6)有同学认为用上述方法所测定的铁元素的含量比实际含量偏大(上述实验操作、计算均正确),其原因是
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)为防止最后乙溶液中混有BaCO3沉淀而影响实验结果,应将空气中的二氧化碳除去,所以甲装置中可用NaOH溶液;
(2)H2O2溶液将亚硫酸钠氧化为硫酸钠,与BaCl2反应,从而得到BaSO4沉淀,此过程不能引入SO42-离子,据此判断判断;
(3)计算出硫酸钡中硫元素质量与黄铁矿质量计算得出答案;
(4)利用氧化还原反应方程式配平规律写出化学方程式;
(5)根据高锰酸钾的物质的量计算出Fe2+的物质的量,利用铁原子守恒,计算出铁的含量;
(6)根据步骤Ⅲ中操作分析判断.
(2)H2O2溶液将亚硫酸钠氧化为硫酸钠,与BaCl2反应,从而得到BaSO4沉淀,此过程不能引入SO42-离子,据此判断判断;
(3)计算出硫酸钡中硫元素质量与黄铁矿质量计算得出答案;
(4)利用氧化还原反应方程式配平规律写出化学方程式;
(5)根据高锰酸钾的物质的量计算出Fe2+的物质的量,利用铁原子守恒,计算出铁的含量;
(6)根据步骤Ⅲ中操作分析判断.
解答:
解:(1)为防止最后乙溶液中混有BaCO3沉淀而影响实验结果,应将空气中的二氧化碳除去,所以甲装置中可用NaOH溶液,
故答案为:NaOH(或KOH);
(2)H2O2溶液将亚硫酸钠氧化为硫酸钠,与BaCl2反应,从而得到BaSO4沉淀,此过程不能引入SO42-离子,故排除②④,
故答案为:①③;
(3)生成的BaSO4的质量为m2g,则硫元素质量为
g,则黄铁矿中硫元素的质量分数为
,
故答案为:
;
(4)Fe2+离子被氧化为Fe3+,MnO4-被还原为Mn2+,写出化学方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(5)滤液中含Fe2+:n(Fe2+)=5×0.100mol/L×V×10-3L=5.00V×10-4mol,
样品组含铁元素:n(Fe)=10×
×5.00V×10-4mol=
V×10-2mol,
样品中含铁元素的质量:n(Fe)=56g/mol×
×10-2Vmol=0.187Vg,
故答案为:0.187Vg;
(6)步骤Ⅲ中,①中加入了足量的稀硫酸,②中加入了过量的铁粉,则稀硫酸会与Fe粉反应,增加了滤液中Fe2+的含量,
故答案为:过量的稀硫酸会与Fe粉反应,增加了滤液中Fe2+的含量.
故答案为:NaOH(或KOH);
(2)H2O2溶液将亚硫酸钠氧化为硫酸钠,与BaCl2反应,从而得到BaSO4沉淀,此过程不能引入SO42-离子,故排除②④,
故答案为:①③;
(3)生成的BaSO4的质量为m2g,则硫元素质量为
| 32m2 |
| 233 |
| 32m2 |
| 233m1 |
故答案为:
| 32m2 |
| 233m1 |
(4)Fe2+离子被氧化为Fe3+,MnO4-被还原为Mn2+,写出化学方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(5)滤液中含Fe2+:n(Fe2+)=5×0.100mol/L×V×10-3L=5.00V×10-4mol,
样品组含铁元素:n(Fe)=10×
| 2 |
| 3 |
| 1 |
| 3 |
样品中含铁元素的质量:n(Fe)=56g/mol×
| 1 |
| 3 |
故答案为:0.187Vg;
(6)步骤Ⅲ中,①中加入了足量的稀硫酸,②中加入了过量的铁粉,则稀硫酸会与Fe粉反应,增加了滤液中Fe2+的含量,
故答案为:过量的稀硫酸会与Fe粉反应,增加了滤液中Fe2+的含量.
点评:本题考查学生对实验原理的理解、实验基本操作、对操作的评价、氧化还原滴定、化学计算等,综合性较大,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)( )
A、 制溴苯 |
B、 实验室制取乙酸乙酯 |
C、 石油分馏 |
D、 实验室制取硝基苯 |
主链含有4个碳原子,且含有4个甲基的烷烃有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
科技报道:美国夏威夷联合天文台中心的科学家发现了新的氢微粒.这种氢微粒是由3个氢原子核(只含质子)和2个电子构成的,这对解释宇宙演化提供了新的参考.对于这种氢微粒,下列说法错误的是( )
| A、可以推测它的化学性质与H2不同 |
| B、它比普通氢分子多一个氢原子核 |
| C、它的组成可以用H3+表示 |
| D、它一定含有3个中子 |
下列化学方程式或离子方程式正确的是( )
A、H2S在过量的O2中燃烧:2H2S+O2
| ||||
| B、向稀HNO3中加入过量的铁:Fe+4H++NO3-═Fe3++NO↑+2H2O | ||||
| C、向氯化铝溶液滴加过量的氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ | ||||
| D、向稀NH4HSO3溶液中滴加少量的稀NaOH溶液:NH4++OH-═NH3?H2O |
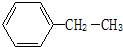
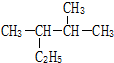
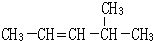
 (1)如图是维生素A的分子结构:
(1)如图是维生素A的分子结构: