题目内容
9.下列物质性质的比较,正确的是( )| A. | 热稳定性:Na2CO3>NaHCO3>H2CO3 | B. | 熔点:K>Na>Li | ||
| C. | 溶解度:NaHCO3>Na2CO3 | D. | 氧化性:Li+<Na+<K+ |
分析 A.NaHCO3不稳定,加热易分解,碳酸不加热即可水解;
B.碱金属单质随核电荷数递增,熔沸点逐渐降低;
C.Na2CO3的溶解度大于NaHCO3;
D.碱金属单质随核电荷数递增,还原性逐渐增强,对应离子的氧化性逐渐减弱.
解答 解:A.Na2CO3稳定,受热不分解,NaHCO3不稳定,加热易分解,碳酸不加热即可水解,热稳定性:Na2CO3>NaHCO3>H2CO3,故A正确;
B.碱金属单质随核电荷数递增,熔沸点逐渐降低,因此熔点:K<Na<Li,故B错误;
C.Na2CO3的溶解度大于NaHCO3,故C错误;
D.碱金属单质随核电荷数递增,还原性逐渐增强,对应离子的氧化性逐渐减弱,氧化性:Li+>Na+>K+,故D错误;
故选A.
点评 本题考查Na2CO3和NaHCO3性质的异同和元素周期律,题目难度不大,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累.

练习册系列答案
相关题目
19.粗铜中一般含有锌、铁、银、金等杂质.在下图所示的装置中,甲池的总反应方程式为2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯铜电极质量增加了3.2g.在此过程中,下列说法正确的是( )

| A. | 乙池中CuSO4溶液的浓度不变 | |
| B. | 甲池中理论上消耗标准状况下空气的体积是2.8L(空气中O2体积分数以20%计算) | |
| C. | 甲池是电能转化为化学能的装置,乙池是化学能转化为电能的装置 | |
| D. | 甲池中通入CH3OH一极的电极反应为CH3OH-6e-+2H2O═CO32-+8H+ |
20.设NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 1mol NH4+和1mol OH-所含电子数均为10NA | |
| B. | 14gC2H4和14gC3H6 所含原子数均为3NA | |
| C. | 1L l mol/LH2SO4溶液与足量Zn充分反应生成22.4L H2 | |
| D. | 标准状况下,11.2LSO3所含分子数为0.5NA |
4.已知:S(s)+O2(g)→SO2(g)+297.16kJ,2SO2(g)+O2(g)═2SO3(g)+196.6kJ,下列说法正确的是( )
| A. | 1molSO2(g)的能量总和大于lmolS(s)和lmolO2(g)的能量总和 | |
| B. | 将2molSO2(g)与lmolO2(g)在一定条件下充分反应,放出196.6kJ的热量 | |
| C. | S(g)+O2(g)→SO2(g)+Q,Q值小于297.16kJ | |
| D. | 当lmolS(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |

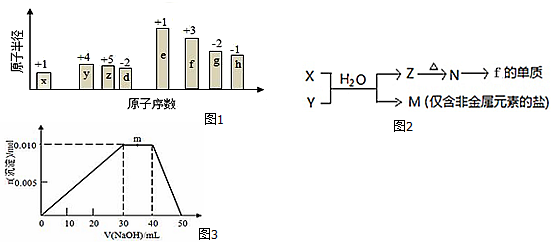
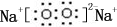 ;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)
;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)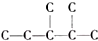 ,此烷烃的一溴代物有6 种,若此烷烃为炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH.
,此烷烃的一溴代物有6 种,若此烷烃为炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH.