题目内容
11.1gNaClO2的物质的量$\frac{1g}{90.5g/mol}$=$\frac{1}{90.5}$mol,依据电子转移数目相等,NaClO2~Cl-~4e-,Cl2~2Cl-~2e-,可知氯气的物质的量为$\frac{1}{90.5}$mol×4×$\frac{1}{2}$=$\frac{2}{90.5}$mol,则氯气的质量为1.57g.分析 依据电子转移数目相等,NaClO2~Cl-~4e-,Cl2~2Cl-~2e-,NaClO2~2Cl2~4e-,依据n=$\frac{m}{M}$计算物质的量和质量.
解答 解:由电子转移数目相等,可知NaClO2~Cl-~4e-,Cl2~2Cl-~2e-,
1gNaClO2的物质的量=$\frac{1g}{90.5g/mol}$=$\frac{1}{90.5}$mol,
NaClO2~2Cl2~4e-,
1 2
$\frac{1}{90.5}$mol $\frac{2}{90.5}$mol
则氯气的质量=$\frac{2}{90.5}$mol×71g/mol=1.57g,
故答案为:1.57g.
点评 本题考查了氧化还原反应电子转移守恒的分析应用,物质的量和质量的计算是解题关键,题目难度不大.

练习册系列答案
相关题目
1.对于装修房子及入住新房子,下列做法不正确的是( )
| A. | 房子装修要选择经过严格检测的、环保的装修材料 | |
| B. | 房子装修好后不能立即入住,最好通风透气两个月以上 | |
| C. | 搬进新居后须日夜关好门窗,防止小偷进入 | |
| D. | 室内放些芦荟、吊兰、常青藤等绿色植物,防止装修材料带来的污染 |
19.下列离子方程式正确的是( )
| A. | 石灰石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | CuCl2溶液中投入单质Na:2Na+Cu2+═2Na++Cu | |
| C. | FeCl3溶液中投入单质Cu:Fe3++Cu═Fe2++Cu2+ | |
| D. | 碳酸氢钠溶液与少量澄清石灰水反应:HCO3-+Ca2++2OH-═CaCO3↓+H2O+CO32- |
6.
回答下类问题:
(1)C元素在元素周期表中的位置层第二周期ⅤA族;
(2)D元素的原子结构示意图 ;
;
(3)E、F、G三种元素形成的简单离子半径最小的是Na+.
| 元素 | 元素的相关信息 |
| A | 存在多种核素,其中一种核素没有中子 |
| B | 形成化合物种类最多的元素 |
| C | 其最高价氧化物的水化物能与其气态氢化物反应生成盐 |
| D | 最外层电子数是内层电子数3倍的元素 |
| E | 单质或其化合物在火焰灼烧时,火焰呈黄色 |
| F | 最高正价与负价的代数和为4 |
| G | 对应的最高价氧化物的水化物的酸性最强 |
(1)C元素在元素周期表中的位置层第二周期ⅤA族;
(2)D元素的原子结构示意图
 ;
;(3)E、F、G三种元素形成的简单离子半径最小的是Na+.
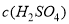 =____________________________.
=____________________________. D.1mol CH3COOK约含有3×6.02×1023个H
D.1mol CH3COOK约含有3×6.02×1023个H