题目内容
现有一定体积的HCl气体,将其溶于100mL稀硫酸中,假设溶液的体积不变,向混合溶液中加入4mol•L-1的NaOH溶液10mL恰好呈中性.继续向所得中性溶液中滴入过量的Ba(OH)2 溶液,所得沉淀质量为2.33g.
(1)生成沉淀的化学方程式为_________________________.
(2)硫酸的物质的量浓度: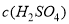 =____________________________.
=____________________________.
(3)该HCl气体在标准状况下的体积为_____________mL.
(4)若向该混酸溶液(仍为100mL)中加入Na2CO3•10H2O晶体,直到不再产生气体时为止,消耗Na2CO3•10H2O晶体的质量为____________g
| A. | 蛋白质在酶或酸、碱的作用下能发生水解,最终生成氨基酸 | |
| B. | 人体的主要供能物质:葡萄糖、脂肪、蛋白质中,脂肪的供能最高 | |
| C. | 某些具有酸味的含有丰富维生素C的新鲜水果、蔬菜,是酸性食物 | |
| D. | 洁净的自来水是人体每天补充水分的最好选择 |

| A. | 常温常压下,L是一种液态有机物 | B. | E中化学键是极性键 | ||
| C. | F具有漂白性 | D. | 上述反应的类型是取代反应 |
| A. | 实验室由乙醇生成乙烯,温度控制在170℃而不是140℃ | |
| B. | 高锰酸钾溶液与H2C2O4反应时加入MnSO4 | |
| C. | 铜与浓硫酸反应时将铜丝绕成螺旋状 | |
| D. | 实验室制备乙炔时用饱和食盐水代替水 |
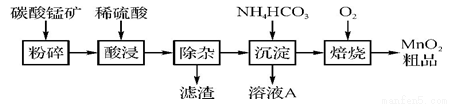
工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下图:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
问答下列问题:
(1) 酸浸前将碳酸锰矿粉碎的作用是 。
(2) 酸浸后的溶液中含有Mn2+、SO42-,另含有少量Fe2+、Fe3+、Al3+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其反应的离子方程式为 。
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是 。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去 。
(3) 从溶液A中回收的主要物质是 ,该物质常用作化肥。
(4) MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应的化学方程式: 。



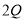 +R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物
+R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物 的质量比为
的质量比为