题目内容
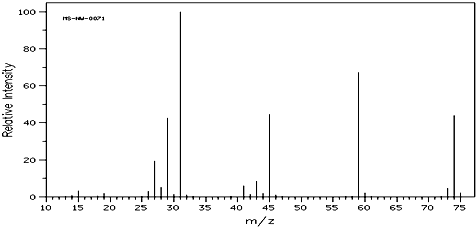
(1)某有机物含有C、H、O三种元素.经燃烧分析实验测定其碳的质量分数是64.86%.氢的质量分数是13.51%.如图是该有机物的质谱图.则该有机物的分子式为
(2)完全燃烧某有机物4.3g生成4.48L(标准状况)CO2和2.7g H2O.则该有机物的实验式为 .

(2)完全燃烧某有机物4.3g生成4.48L(标准状况)CO2和2.7g H2O.则该有机物的实验式为
考点:有机物实验式和分子式的确定
专题:有机化学基础
分析:(1)根据质谱图中数据判断该有机物的相对分子量,计算出氧元素的质量分数,然后计算出C、H、O元素的物质的量之比,从而得出其实验式,再根据其相对分子量计算出其分子式;
(2)根据CO2的体积,求出C的质量和物质的量,根据水的质量,求出H的质量和物质的量,根据质量守恒,确定有机物中是否含有氧,以此该求出有机物的实验式.
(2)根据CO2的体积,求出C的质量和物质的量,根据水的质量,求出H的质量和物质的量,根据质量守恒,确定有机物中是否含有氧,以此该求出有机物的实验式.
解答:
解:(1)根据质谱图可知,该有机物的相对分子质量为74,碳的质量分数是64.86%,氢的质量分数是13.51%,氧元素质量分数为:1-64.86%-13.52=21.63%,则该物质中碳、氢、氧原子个数之比=
:
:
=4:10:1,所以其实验式为:C4H10O,该实验式的式量为74,该有机物的相对分子质量为74,则该有机物的分子式与实验式相同,都是C4H10O,
故答案为:C4H10O;
(2)n(H2O)=
=0.15mol,n(H)=n(H2O)×2=0.3mol,m(H)=0.3g;
n(CO2)=
=0.2mol,n(C)=n(CO2)=0.2mol,m(C)=2.4g,
m(C)+m(H)=2.7g,因有机物的质量为4.3g,所以有机物中含有氧原子,m(O)=4.3g-2.7g=1.6g,n(O)=
=0.1mol,
则有机物中C、H、O的物质的量之比为0.2mol:0.3mol:0.1mol,因此该有机物的实验式为C2H3O,
故答案为:C2H3O.
| 64.86% |
| 12 |
| 13.51% |
| 1 |
| 21.63% |
| 16 |
故答案为:C4H10O;
(2)n(H2O)=
| 2.7g |
| 18g/mol |
n(CO2)=
| 4.48L |
| 22.4L/mol |
m(C)+m(H)=2.7g,因有机物的质量为4.3g,所以有机物中含有氧原子,m(O)=4.3g-2.7g=1.6g,n(O)=
| 1.6g |
| 16g/mol |
则有机物中C、H、O的物质的量之比为0.2mol:0.3mol:0.1mol,因此该有机物的实验式为C2H3O,
故答案为:C2H3O.
点评:本题考查了有机物实验式、分子式的确定,题目难度中等,注意掌握有机物分子式的计算方法,明确质谱图的含义,能够根据质谱图判断物质的相对分子量,(2)中计算是否含氧可根据质量守恒来确定和计算

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
下列各组反应中最终肯定不生成白色沉淀的是( )
| A、AlCl3溶液中加入过量氨水 |
| B、Al2(SO4)3溶液中加入过量KOH溶液 |
| C、MgCl2溶液中加入过量氨水 |
| D、澄清石灰水中通入过量CO2 |
下列各选项所描述的两个量,前者一定大于后者的是( )
| A、纯水在25℃和80℃时的pH值 |
| B、25℃时,pH=3的盐酸和AlCl3溶液中,水电离的氢离子的浓度 |
| C、耐火材料CaO和MgO的熔点 |
| D、1L pH=2的盐酸和醋酸溶液中,分别投入足量锌粒,放出H2的物质的量 |
某物质的分子式为C2H6O,若要确定其共价键种类,下列方法能实现的是( )
| A、质谱法 | B、李比希法 |
| C、红外光谱法 | D、核磁共振氢谱法 |
