题目内容
16.类比推理是化学中常用的思维方法.下列推理正确的是( )| A. | Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3 | |
| B. | SiH4的沸点高于CH4,推测H2S的沸点高于H2O | |
| C. | CO2是直线型分子,推测CS2也是直线型分子 | |
| D. | NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr |
分析 A.I2的氧化性较弱,碘单质与铁反应生成FeI2;
B.C和Si,O和S都分别同族元素,形成的氢化物都为分子晶体,沸点取决于分子间作用力的大小;
C.O和S同主族,二者形成的CO2和CS2都是直线形分子;
D.浓硫酸能够将HBr氧化为Br2.
解答 解:A.因I2的氧化性较弱,在碘单质与铁反应生成的是FeI2,故A错误;
B.C和Si,O和S都分别为同族元素,所形成的氢化物都为分子晶体,而水分子间存在氢键,所以沸点异常的高,则H2O沸点高于H2S,故B错误;
C.O和S是同族元素,故形成的CO2和CS2都是直线形分子,该推理合理,故C正确;
D.浓硫酸氧化性很强,能够将HBr氧化为Br2,不能用该方法制取HBr,故D错误;
故选C.
点评 本题考查较为综合,涉及分子构型、晶体性质、铁的化学性质、浓硫酸的性质等知识,题目难度中等,明确常见元素及其化合物性质为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
6.下列有关方程式正确的是( )
| A. | 向硫酸亚铁溶液中加入双氧水的离子方程式:Fe2++2H2O+4H+=Fe3++4H2O | |
| B. | 粗硅制备的化学方程式:C+SiO2$\frac{\underline{\;高温\;}}{\;}$CO2↑+Si | |
| C. | 石墨作电极电解CuSO4溶液的离子方程式:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 铁发生吸氧腐蚀时负极上的电极反应式:Fe-3e-=Fe3+ |
11.下列各组有机物中,不论两者以何种比例混合,只要总物质的量一定,则完全燃烧时生成的水的质量和消耗的氧气的质量不变的是( )
| A. | C3H8,C4H6 | B. | C3H6,C4H6O2 | C. | C2H2,C6H6 | D. | CH4O,C2H4O2 |
1.观察下列几个装置示意图,有关叙述正确的是( )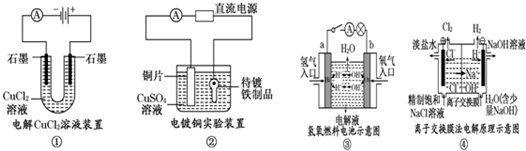

| A. | 装置①中阳极上析出红色固体 | |
| B. | 装置②的待镀铁制品应与电源负极相连 | |
| C. | 装置③中外电路电子由a极流向b极 | |
| D. | 装置④的阳极反应为:2H++2e-=H2↑ |
6.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 23g金属钠变为钠离子时失电子数目为1 NA | |
| B. | 18g水所含有的电子数为NA | |
| C. | 4克氢气所含的分子数为NA | |
| D. | 4gCH4所含有的氢原子数目为2NA |
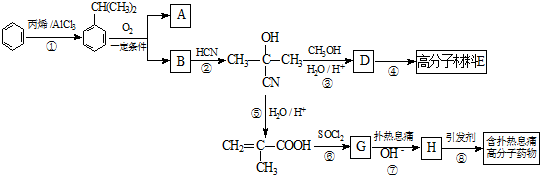
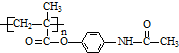 .
.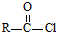
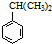 可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式

 .
. 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题: