题目内容
16.如图中a、b、c、d为周期表前4周期的部分元素,下列叙述正确的是( )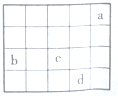
| A. | 四种元素中,d单质的化学性质最稳定 | |
| B. | 气态氢化物的还原性:d>c | |
| C. | 原子半径:b<c | |
| D. | b元素最高价氧化物可形成原子晶体 |
分析 图为元素周期表中前4周期相邻的一部分元素,由元素在周期表中的位置可知,a为He、b为Si、c为S、d为Br,
A.稀有气体的性质最稳定;
B.非金属性越强,气态氢化物的还原性越强;
C.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大;
D.b元素最高价氧化物为SiO2.
解答 解:图为元素周期表中前4周期相邻的一部分元素,由元素在周期表中的位置可知,a为He、b为Si、c为S、d为Br,
A.a的最外层为2电子稳定结构,则a的单质性质最稳定,故A错误;
B.由H2S+Br2=2HBr+S可知,非金属性Br>S,则气态氢化物的还原性:d<c,故B错误;
C.同周期随原子序数增大原子半径减小,则原子半径:b>c,故C错误;
D.b元素最高价氧化物为SiO2,作用力为共价键,构成微粒为原子,属于原子晶体,故D正确;
故选D.
点评 本题考查位置、结构与性质的关系,为高频考点,把握a为He元素及元素化合物知识为解答的关键,侧重分析、推断及应用能力的考查,注意元素在周期表中的位置,选项B为解答的难点,题目难度不大.

练习册系列答案
相关题目
6.下列各项中实验的设计或操作能达到预期实验目的是( )
| 选项 | 实验目的 | 实验的设计或操作 |
| A | 比较Cl与S元素的非金属性强弱 | 相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH |
| B | 比较Ksp(AgCl)与Ksp(AgI)的大小 | 向AgCl浊液中滴入少量的KI溶液,振荡 |
| C | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| D | 证明氧化性H2O2比Fe3+强 | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 |
| A. | A | B. | B | C. | C | D. | D |
7.LED产品的使用为城市增添色彩.如图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
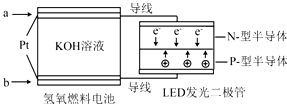

| A. | b处通入H2 | |
| B. | 该装置将化学能最终转化为电能 | |
| C. | 通入H2的电极发生反应:2H2-4e-=4H+ | |
| D. | a处为电池负极,发生了氧化反应 |
4.下列说法正确的是( )
| A. | 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,下层溶液呈紫红色,说明氧化性:Br2>Fe3+>I2 | |
| B. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量 | |
| C. | 常温下,0.1 mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-12,溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 | |
| D. | 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,不能说明Na2O2是否变质 |
11.下列有关制取溴苯的实验描述正确的是( )
| A. | 在苯和液溴的混合物中,添加少量铁屑后马上剧烈反应 | |
| B. | 伸出烧瓶的导管要有足够长度,其作用是导出气体和充分冷凝回流逸出的苯和溴蒸气 | |
| C. | 导管末端应插入锥形瓶内水面以下,有利于HBr气体被吸收 | |
| D. | 反应后烧瓶中是褐色的油状液体,倒入盛有足量浓烧碱溶液的分液漏斗中,充分振荡后静置,上层液体是无色的溴苯 |
1.醋酸异丁酯(a)和香豆素(b)均是用途广泛的香料,下列有关说法正确的是( )

| A. | a属于不饱和烃 | |
| B. | a、b含有的官能团种类相同 | |
| C. | 1molb最多能和4molH2反应 | |
| D. | 等物质的量的a、b最多消耗NaOH的量相同 |
12.下列说法正确的是( )
| A. | 乳酸薄荷醇酯(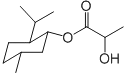 )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 | |
| B. | 乙醛和丙烯醛(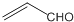 )不是同系物,它们与氢气充分反应后的产物是同系物 )不是同系物,它们与氢气充分反应后的产物是同系物 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| D. | CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,核磁共振氢谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用核磁共振氢谱鉴别 |
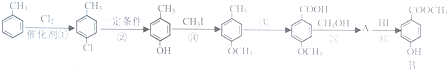
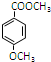 ,反应③的反应类型为取代反应.
,反应③的反应类型为取代反应.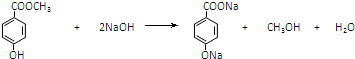 .
.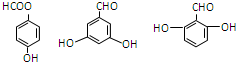 .
.