题目内容
6.下列关于物质性质变化的比较中,不正确的是( )| A. | 碱性强弱:KOH>NaOH>LiOH | B. | 原子半径大小:Na>S>O | ||
| C. | 酸性强弱:HIO4>HBrO4>HClO4 | D. | 金属性强弱:Na>Mg>Al |
分析 A.金属的金属性越强,最高价氧化物对应水合物的碱性越强;
B.电子层越多,原子半径越大,电子层相同的原子,核电荷数越大,原子半径越小;
C.非金属性越强,最高价氧化物对应水合物的酸性越强;
D.同一周期,原子序数越大,非金属性越强,金属性越弱.
解答 解:A.金属性:K>Na>Li,则最高价氧化物对应水合物的碱性强弱为:KOH>NaOH>LiOH,故A正确;
B.O原子含有2个电子层,则氧原子的原子半径最小;Na、S的电子层数相同,Na的核电荷数较小,则原子半径Na>S,所以原子半径大小为:Na>S>O,故B正确;
C.非金属性:I<Br<Cl,则最高价氧化物对应水合物的酸性大小为:HIO4<HBrO4<HClO4,故C错误;
D.同一周期的元素,原子序数越大,金属性越弱,原子序数:Na<Mg<Al,则金属性:Na>Mg>Al,故D正确;
故选C.
点评 本题考查了元素周期律的内容及其应用,题目难度中等,明确原子结构与元素周期律的关系为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
14.进入化学实验室必须注意安全,下列说法不正确的是( )
| A. | 不慎将酸溅到眼里,应立即用水冲洗,边洗边眨眼 | |
| B. | 酒精着火时,可用湿抹布将其扑面 | |
| C. | 实验室中进行可燃性气体燃烧性质实验时,必须先验纯后点燃 | |
| D. | 稀释浓硫酸时,可先在量筒中加一定体积的水,再一边搅拌,一边慢慢加入浓硫酸 |
18.下列说法正确的是( )
| A. | 盐酸能导电,所以盐酸是电解质 | |
| B. | 纯碱的化学式:NaOH | |
| C. | 碳酸钾的电离方程式:K2CO3=2K+1+CO3-2 | |
| D. | 氯离子的结构示意图为: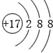 |
15.下列实验现象和结论相符的是( )
| A. | 某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体,则溶液中一定含有CO32- | |
| B. | 某溶液中加入硝酸银,产生白色沉淀,则溶液中一定含有Cl- | |
| C. | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色溶液中有Na+,无K+ | |
| D. | 向某溶液中先加几滴KSCN溶液,无明显现象,再滴新制氯水,溶液变红溶液中一定含有Fe2+ |
16.室温下,对于0.10mol•L-1的氨水,下列判断正确的是( )
| A. | 与AlCl3溶液发生反应的离子方程式为Al3++3OH-═Al(OH)3↓ | |
| B. | 加水稀释,氨水的电离平衡向逆反应方向移动 | |
| C. | 用HNO3溶液恰好完全中和,中和后溶液不显中性 | |
| D. | 其溶液的pH=13 |

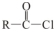 +R′OH→
+R′OH→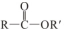 +HCl
+HCl
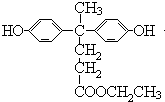 .
.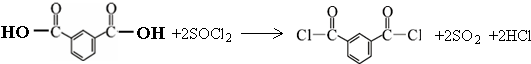 .
. 的路线.
的路线.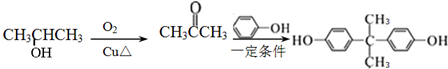 .
.