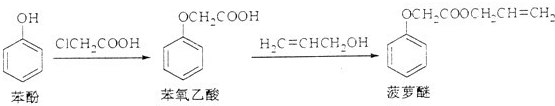
题目内容
将下列物质进行分类:
①11H 与 13H ②O2 与O3 ③乙醇与甲醚(CH3-O-CH3)④H2O 与 D2O ⑤CH3CH2CH2CH3 与CH3-CH(CH3)-CH3 ⑥C60 与C70⑦CH4与C4H10
(1)互为同位素的是 (填编号,下同);互为同素异形体的是 ;互为同分异构体的是 ;互为同系物的是 .
(2)有下列反应:①由乙烯制乙醇 ②甲烷在空气中燃烧③由乙烯制氯乙烷 ④丙烯使溴水褪色 ⑤苯与浓硝酸、浓硫酸的混合酸反应 ⑥用丙烯制聚丙烯;其中属于取代反应的是(填序号,下同) ,属于氧化反应的是 ,属于加成反应的是 ,属于加聚反应的是 .
(3)①正丁烷 ②异丁烷 ③正戊烷 ④异戊烷 ⑤新戊烷 ⑥丙烷,物质的沸点由高到低的排列顺序是:
(4)某学生用0.100mol?L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
正确操作步骤的顺序是(用序号字母填写) .
①11H 与 13H ②O2 与O3 ③乙醇与甲醚(CH3-O-CH3)④H2O 与 D2O ⑤CH3CH2CH2CH3 与CH3-CH(CH3)-CH3 ⑥C60 与C70⑦CH4与C4H10
(1)互为同位素的是
(2)有下列反应:①由乙烯制乙醇 ②甲烷在空气中燃烧③由乙烯制氯乙烷 ④丙烯使溴水褪色 ⑤苯与浓硝酸、浓硫酸的混合酸反应 ⑥用丙烯制聚丙烯;其中属于取代反应的是(填序号,下同)
(3)①正丁烷 ②异丁烷 ③正戊烷 ④异戊烷 ⑤新戊烷 ⑥丙烷,物质的沸点由高到低的排列顺序是:
(4)某学生用0.100mol?L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
正确操作步骤的顺序是(用序号字母填写)
考点:有机物的结构和性质,同位素及其应用,同素异形体,同分异构现象和同分异构体,有机化学反应的综合应用,中和滴定
专题:实验题,有机反应
分析:(1)具有相同质子数、不同中子数的原子,互为同位素;
同种元素的不同单质,互为同素异形体;
分子式相同、结构不同的有机物,互为同分异构体;
结构相似,组成相差n个CH2原子团的有机物互为同系物,官能团的数目、种类应相同;
(2)乙烯中含碳碳双键,可发生氧化、加成反应,苯易发生取代反应,甲烷燃烧为氧化反应;
(3)碳原子个数越多,沸点越高;具有相同C原子数的烃,支链越多,沸点越低;
(4)根据中和滴定有检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等操作分析.
同种元素的不同单质,互为同素异形体;
分子式相同、结构不同的有机物,互为同分异构体;
结构相似,组成相差n个CH2原子团的有机物互为同系物,官能团的数目、种类应相同;
(2)乙烯中含碳碳双键,可发生氧化、加成反应,苯易发生取代反应,甲烷燃烧为氧化反应;
(3)碳原子个数越多,沸点越高;具有相同C原子数的烃,支链越多,沸点越低;
(4)根据中和滴定有检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等操作分析.
解答:
解:(1)只有①11H 与 13H 符合具有相同质子数、不同中子数的原子,互为同位素;
只有②⑥符合同种元素的不同单质,互为同素异形体;
只有③⑤符合分子式相同、结构不同的有机物,互为同分异构体;
只有⑦均为烷烃,符合结构相似,组成相差n个CH2原子团的有机物,二者互为同系物,
故答案为:①;②⑥;③⑤;⑦;
(2)①由乙烯制乙醇,发生碳碳双键与水的加成反应;②甲烷在空气中燃烧,为氧化反应;③由乙烯制氯乙烷,发生乙烯与HCl的加成反应;④丙烯使溴水褪色,发生碳碳双键与溴水的加成反应;⑤苯与浓硝酸、浓硫酸的混合酸反应,发生苯的取代反应; ⑥用丙烯制聚丙烯,为碳碳双键的加聚反应,则属于取代反应的⑤,属于氧化反应为②,属于加成反应的是①③④⑥,属于加聚反应的是⑥,
故答案为:⑤;②;①③④⑥;⑥;
(3)碳原子个数越多,沸点越高;具有相同C原子数的烃,支链越多,沸点越低,则沸点为③>④>⑤>①>②>⑥,故答案为:③>④>⑤>①>②>⑥;
(4)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,则正确的顺序为BDCEAF,
故答案为:BDCEAF.
只有②⑥符合同种元素的不同单质,互为同素异形体;
只有③⑤符合分子式相同、结构不同的有机物,互为同分异构体;
只有⑦均为烷烃,符合结构相似,组成相差n个CH2原子团的有机物,二者互为同系物,
故答案为:①;②⑥;③⑤;⑦;
(2)①由乙烯制乙醇,发生碳碳双键与水的加成反应;②甲烷在空气中燃烧,为氧化反应;③由乙烯制氯乙烷,发生乙烯与HCl的加成反应;④丙烯使溴水褪色,发生碳碳双键与溴水的加成反应;⑤苯与浓硝酸、浓硫酸的混合酸反应,发生苯的取代反应; ⑥用丙烯制聚丙烯,为碳碳双键的加聚反应,则属于取代反应的⑤,属于氧化反应为②,属于加成反应的是①③④⑥,属于加聚反应的是⑥,
故答案为:⑤;②;①③④⑥;⑥;
(3)碳原子个数越多,沸点越高;具有相同C原子数的烃,支链越多,沸点越低,则沸点为③>④>⑤>①>②>⑥,故答案为:③>④>⑤>①>②>⑥;
(4)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,则正确的顺序为BDCEAF,
故答案为:BDCEAF.
点评:本题考查较综合,涉及有机物的结构与性质、概念的辨析、沸点的比较、中和滴定等,为高频考点,把握烯烃、苯等有机物的性质及五同概念为解答的关键,侧重基础知识的考查,注题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列各组离子,在pH>7的溶液中能大量共存,且溶液为无色透明的离子组是( )
| A、K+、MnO4-、Cl-、SO42- |
| B、Na+、NO3-、CO32-、Cl- |
| C、Na+、H+、NO3-、SO42- |
| D、K+、NO3-、HCO3-、Cl- |
羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.
下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A、该反应是加成反应 |
| B、上述反应的原子利用率可达到100% |
| C、乙醛酸与H2在热的镍催化下反应生成乙二醇 |
| D、对羟基扁桃酸可以发生加成反应、取代反应和缩聚反应 |
下列实验中,反应速率加快是由催化剂引起的是( )
| A、在炭粉中加入KClO3,点燃时燃烧更为剧烈 |
| B、锌与稀硫酸反应中加入少量CuSO4溶液而使反应放出H2的速率加快 |
| C、固态FeCl3和固体NaOH混合后,加入水能迅速产生沉淀 |
| D、双氧水中加入少量MnO2,即可迅速放出气体 |
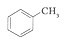 和
和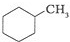 .其中互为同分异构体的是
.其中互为同分异构体的是 )、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH).
)、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH).