题目内容
8.尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.
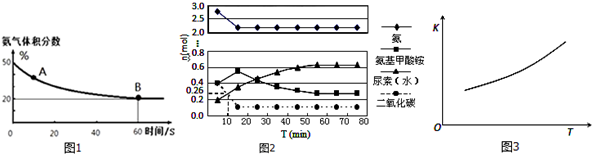
①A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为75%.
②关于上述反应的平衡状态下列说法正确的是B
A.分离出少量的尿素,反应物的转化率将增大
B.平衡时再充入一定量H2O(g),CO2的转化率增大
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高尿素的产率
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)?H2NCOONH4(l) (氨基甲酸铵)△H1
第二步:H2NCOONH4(l)?H2O(l)+H2NCONH2(l)△H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5L密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图2所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第2步反应决定,总反应进行到55 min时到达平衡.
②反应进行到10min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=0.148mol/L•min.
③第二步反应的平衡常数K随温度的变化如图3所示,则△H2>0(填“>”“<”或“=”)
④第一步反应的△S<0(填“>”、“<”或,“=”),在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=0.1mol/L;NH4+水解平衡常数值为4×10-9.
分析 (1)①图象分析氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率;依据氨气的体积分数结合平衡三段式列式计算平衡转化率;
②A.因为氨基甲酸铵为固体,分离出少量的氨基甲酸铵,平衡不移动;
B.氨基甲酸铵为固体,平衡时再充入一定量H2O(g),相当于对原平衡体系加压;
C.转化率与反应物的起始的量有关,据此分析;
D.催化剂只改变速率,不改变平衡移动,由此进行判断;
(2)①已知总反应的快慢由慢的一步决定,结合图象变化趋势,图象表达反应的判断,反应快慢可以依据第一步和第二步反应的曲线斜率比较大小;当氨基甲酸铵,尿素物质的量不再变化时,反应达到平衡;
②分析图象计算10分钟时二氧化碳的消耗物质的量,结合化学反应速率概念计算得到;
③依据化学平衡常数的表达意义和计算分析判断平衡移动方向;
④根据第一步的方程式可知,反应物中有气体,生成物中没气体,所以△S<0,根据△G=△H-T△S判断;
(3)根据氨基甲酸铵极易水解成碳酸铵,即反应式为NH2COONH4(s)+H2O?(NH4)2CO3,将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7并且溶液中几乎不含碳元素,所以溶液中只有H+、NH4+、OH-、Cl-,根据电荷守恒计算c(NH4+),根据NH4++H2O?NH3•H2O+OH-结合K=$\frac{c(NH{\;}_{3}•H{\;}_{2}O)c(H{\;}^{+})}{c(NH{\;}_{4}{\;}^{+})}$进行计算;
解答 解:(1)①氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率,故v正(CO2)>v逆(CO2);
设氨气为50mol,二氧化碳为50mol,氨气消耗的物质的量x,开始氨气体积分数为50%,则
2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)
起始量(mol) 50 50 0 0
变化量(mol) x 0.5x 0.5x 0.5x
平衡量(mol) 50-x 50-0.5x 0.5x 0.5x
平衡时氨气的体积分数为20%,故$\frac{50-x}{50-0.5x+50-x+0.5x}$=20%;解得x=37.5mol,
故氨气的平衡转化率=$\frac{37.5mol}{50mol}$=75%,
故答案为:>;75%;
②A.因为氨基甲酸铵为固体,分离出少量的氨基甲酸铵,平衡不移动,所以反应物的转化率不变,故A错误;
B.氨基甲酸铵为固体,平衡时再充入一定量H2O(g),相当于对原平衡体系加压,则CO2的转化率增大,故B正确;
C.转化率与反应物的起始的量有关,所以NH3的转化率不一定等于CO2的转化率,故C错误;
D.催化剂只改变速率,不改变平衡移动,所以加入有效的催化剂不能够提高氨基甲酸铵的产率,故D错误;
故选:B;
(2)①由图象可知在15分钟左右,氨气和二氧化碳反应生成氨基甲酸铵后不再变化发生的是第一步反应,氨基甲酸铵先增大再减小最后达到平衡,发生的是第二步反应,从曲线斜率不难看出第二步反应速率慢,所以已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第二步决定,由图象变化可知当进行到55分钟时,反应达到平衡,
故答案为:2;55;
②依据图象分析,二氧化碳再进行到 10min时物质的量为0.26mol,所以此时的反应速率=$\frac{\frac{1mol-0.26mol}{0.5L}}{10min}$=0.148mol/L•min,
故答案为:0.148mol/L•min;
③第二步反应的平衡常数K随温度的升高增大,说明反应是吸热反应,△H2>0,
故答案为:>;
④根据第一步的方程式可知,反应物中有气体,生成物中没气体,所以△S<0,根据△G=△H-T△S可知,温度较低时,△G可能小于0,即反应可以自发,
故答案为:<;较低;
(4)因为氨基甲酸铵极易水解成碳酸铵,即反应式为NH2COONH4(s)+H2O?(NH4)2CO3,加入1L0.1mol/L的盐酸溶液中直到溶液pH=7并且溶液中几乎不含碳元素,所以溶液中只有H+、NH4+、OH-、Cl-,根据电荷守恒c(NH4+)=c(Cl-)=0.1mol/L,又用去0.052mol氨基甲酸铵,所以开始溶液中的铵根离子浓度为0.052mol/L×2=0.104mol/L,
NH4++H2O?NH3•H2O+H+;
开始 0.104mol/L 0
转化 0.004mol/L 0.004mol/L
平衡 0.1mol/L 0.004mol/L
又溶液为pH=7,所以氢离子浓度为10-7mol/L,则NH4+水解平衡常数K=$\frac{c(NH{\;}_{3}•H{\;}_{2}O)c(H{\;}^{+})}{c(NH{\;}_{4}{\;}^{+})}$=$\frac{0.004×1{0}^{\;}{\;}^{-7}}{0.1}$=4×10-9,
故答案为:0.1mol/L;4×10-9.
点评 本题考查了化学平衡、及转化率的相关计算、化学平衡的移动原理等知识,图象分析反应的进行程度,掌握基础,分析题干是解题关键,题目难度中等.

| A. | 单质的沸点:Y<X | B. | 简单离子半径:Y<Z | ||
| C. | 盐M的水溶液显酸性 | D. | 最高化合价:X>Y>Z |

根据实验所得数据,有关说法正确的是( )
| A. | 无色气体的质量为0.2g | |
| B. | 原混合物中铁的质量分数无法计算 | |
| C. | 实验中消耗的H2SO4物质的量为0.1mol | |
| D. | 溶液中金属离子物质的量为0.02mol |
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
| A. | 制纯碱:往NaOH溶液中 通入少量CO2气体,再蒸发溶液 | |
| B. | 制氯气:以粗盐为原料,经过除杂、浓缩得饱和食盐水,再进行电解所得溶液 | |
| C. | 制镁:用海水为原料,经一系列过程制得氧化镁固体,再用H2还原得镁 | |
| D. | 制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝 |
 关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )
关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )| A. | 乙醇可以用来制饮料 | |
| B. | 1 mol乙醇完全燃烧时生成3mol水 | |
| C. | 1mol乙醇与足量的钠作用生成1g H2 | |
| D. | 物质的量相同的乙醇和乙烯气体完全燃烧,耗氧量相同 |
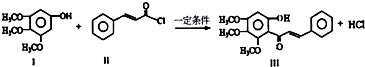
| A. | Ⅰ在空气中不能稳定存在 | |
| B. | 可用FeCl3溶液鉴别有机物Ⅱ和Ⅲ | |
| C. | Ⅱ中所有原子一定不可能共面 | |
| D. | 1mol产物Ⅲ与足量溴水反应,消耗Br2 的物质的量为1.5mol |
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2
反应Ⅲ:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H3
相关反应在不同温度时的平衡常数及其大小关系如下表所示
| 温度/K | 反应Ⅰ | 反应Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |
(1)反应Ⅰ的△S<0(填“>”或“<”);反应Ⅱ的平衡常数表达式为$\frac{c(C{H}_{3}OC{H}_{3})×c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$,反应Ⅲ是放热反应(填“吸热”或“放热”).
(2)在合成过程中,因为有CO(g)+H2O(g)?CO2(g)+H2(g)反应发生,所以能提高CH3OCH3的产率,原因是反应消耗了H2O(g)有利于反应Ⅱ、Ⅲ正向移动;同时此反应生成了H2,有利于反应I、Ⅲ正向移动.
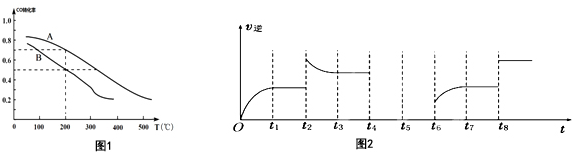
(3)如图1两条曲线分别表示反应I(按物质的量比:n(CO):n(H2)=1:2)中压强为0.1MPa和5.0MPa下CO转化率随温度的变化关系,计算压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是25%.
(4)反应Ⅲ逆反应速率与时间的关系如图2所示:
①试判断t2时改变的条件是升高温度或增大生成物浓度.
②若t4扩大容器体积,t5达到平衡,t6时增大反应物浓度,请在图2中画出t4-t6的变化曲线.
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题: