题目内容
在相同的条件下测得①NaHCO3 ②CH3COONa ③NaClO三种溶液pH相同,则它们的物质的量浓度由大到小的顺序是( )
| A、①>②>③ |
| B、③>②>① |
| C、②>①>③ |
| D、③>①>② |
考点:盐类水解的应用
专题:盐类的水解专题
分析:对应酸的酸性越弱,其盐的水解程度越大,溶液的碱性越强,溶液PH越大;当PH相同时,酸越强,盐的浓度越大.
解答:
解:在相同的条件下测得①NaHCO3 ②CH3COONa ③NaClO三种溶液pH相同,已知酸性:CH3COOH>HClO>HCO3-,所以水解程度:NaClO>NaHCO3>CH3COONa,pH相同时,溶液的浓度:NaClO<NaHCO3<CH3COONa,即②>①>③;
故选C.
故选C.
点评:本题考查盐类的水解,会运用逆向思维进行分析解答本题,注意盐溶液的碱性强弱取决于阴离子的水解能力,当pH相同时,越难水解的盐,其浓度越大,题目难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
氰化物有剧毒,在碱性条件下可用如下方法进行处理:2CN-+12OH-+5Cl2=2CO
+N2+10Cl-+6H2O,则下列判断中,不正确的是( )
2- 3 |
| A、上述反应中的氧化剂是Cl2 |
| B、该反应过程中只有氮元素被氧化 |
| C、还原性:CN->Cl- |
| D、当有1 molCl2参加反应时,转移的电子数为2mol |
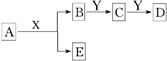 中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去).下列推断正确的是( )
中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去).下列推断正确的是( )| A、若A是CaC2,X是H2O,则Y一定是溴水 |
| B、若A是金属钠,X是H2O,则E一定能还原Fe2O3 |
| C、若Y是NaOH,C是白色沉淀,则A与X一定发生置换反应 |
| D、若Y是氧气,D是氧化物,则A与X一定发生氧化还原反应 |
下列反应的现象描述与离子方程式都正确的是( )
| A、金属镁与稀盐酸反应:有气泡逸出:Mg+2H++2Cl-═MgCl2+H2↑ |
| B、氯化钡溶液与稀硫酸反应:有白色沉淀生成:Ba2++SO42-═BaSO4↓ |
| C、碳酸钠与盐酸反应:有气泡逸出:Na2CO3+2H+═CO2↑+H2O+2Na+ |
| D、硫酸铜溶液中加入过量的NaOH溶液:有白色沉淀产生:Cu2++2OH-═Cu(OH)2↓ |
“阿波罗号飞船”所用的氢氧燃料电池的电极反应为:
负极:2H2+4OH--4e-=4H2O
正极 O2+2H2O+4e-=4OH-
该电池工作时,下列叙述正确的是( )
负极:2H2+4OH--4e-=4H2O
正极 O2+2H2O+4e-=4OH-
该电池工作时,下列叙述正确的是( )
| A、氢气发生还原反应 |
| B、每转移4摩电子,电池内增加4mol水 |
| C、负极附近溶液的PH值降低 |
| D、正极附近C(H+)增大 |
把M mol H2和N mol C2H4混合,在一定条件下使它们一部分发生反应生成W mol C2H6,将反应后的混合气体完全燃烧,消耗氧的物质的量为( )
| A、M+3N | ||||
B、
| ||||
C、
| ||||
D、
|
 5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水.
5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水.