��Ŀ����
����Ŀ����(N2H4)��һ��Ӧ�ù㷺�Ļ���ԭ�ϡ���ҵ���Ⱥϳɰ�����N2(g)+3H2(g)![]() 2NH3(g)��H��0���ٽ�һ���Ʊ��¡����������գ�
2NH3(g)��H��0���ٽ�һ���Ʊ��¡����������գ�
��1���ϳɰ���Ҫѡ����ʵĴ������ֱ�ѡ��A��B��C���ִ����������飬���ý����ͼ��ʾ(����������ͬ)��������������ѡ��Ĵ�����__(����A������B������C��)�������ǣ�__��
��2��һ�������£������ܱ������н��еĺϳɰ���Ӧ��ƽ���������������ʱ����ͬʱѹ������������������¶ȴ���ƽ�����ԭƽ����ȣ��뽫�й��������ı仯����������±���(����������������С��������ȷ����)
��Ӧ���� | ƽ�ⳣ��K | |
�仯��� | ____ | ____ |
��3��ͨ���Ѳ�1molij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ���֪���ֻ�ѧ���ļ������£�
��ѧ�� | N��H | N��N | O==O | N��N | O��H |
����(kJ/mol) | 386 | 167 | 498 | 946 | 460 |
�������۷ɴ��ij������������(N2H4����̬)Ϊȼ�ϣ�����������(��̬)��ȼ�գ�����N2(��̬)��H2O(Һ̬)���÷�Ӧ���Ȼ�ѧ����ʽΪ��____��
��4������Ҫ�����������ʺ����ᡣ��ʮ�������ڼ䣬Ԥ���ҹ��ϳɰ�����������������������ͼ�Dz�ͬ�¶ȺͲ�ͬѹǿ�£���Ӧ�ﵽƽ��������NH3����(���%)�ı仯�������֪��ʼʱn(N2)��n(H2)=1:3���ж�pl��p2ѹǿ�Ĵ�С��ϵ��pl___p2(ѡ��������������������=��)��
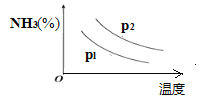
���𰸡�A �ڽϵ��¶��¾߱��ϸߵĴ����ԣ�һ����ɽ�Լ��Դ����һ������������ڷ�Ӧ��ת�� ���� ��С N2H4(g)+O2(g)��N2(g)+2H2O(l) ��H=-577kJ/mol ��pl��p2
��������
(1)����ͼ�������֪������A�ķ�Ӧ���ʼӿ�ı������¶ȵͣ�
(2)������������ʱ����ͬʱѹ��������������൱������ѹǿ�������¶ȴ���ƽ���N2(g)+3H2(g)2NH3(g) ��H��0����ӦΪ���������С�ķ��ȷ�Ӧ������ѹǿƽ�������ƶ��������¶�ƽ�������ƶ����ݴ˷������
(3)��д����ѧ����ʽN2H4+O2�TN2+2H2O��Ȼ������ʱ�=��Ӧ����ܼ���-��������ܼ��ܼ����ʱ䣬��д�Ȼ�ѧ����ʽ��
(4)���ݷ�Ӧ�ķ���ʽ���ƽ���ƶ���ԭ�������жϡ�
(1)�ϳɰ���Ҫѡ����ʵĴ������ֱ�ѡ��A��B��C���ִ����������飬���д���A�ڽϵ��¶��¾߱��ϸߵĴ����ԣ�һ����ɽ�Լ��Դ����һ������������ڷ�Ӧ��ת�����ʴ�Ϊ��A���ڽϵ��¶��¾߱��ϸߵĴ����ԣ�һ����ɽ�Լ��Դ����һ������������ڷ�Ӧ��ת����
(2)һ�������£������ܱ������н��еĺϳɰ���Ӧ��ƽ���������������ʱ����ͬʱѹ������������������¶ȴ���ƽ�����ԭƽ����ȣ���Ӧ�������÷�ӦΪ���ȷ�Ӧ��ƽ�ⳣ��ֻ���¶��йأ��¶����ߣ�ƽ�������ƶ���ƽ�ⳣ����С���ʴ�Ϊ������С��
(3)1molN2H4�����к�4molN-H����1molN-N����N2H4ȼ�յĻ�ѧ����ʽΪN2H4(g)+O2(g)�TN2(g)+2H2O(g)����H=��Ӧ����ܼ���-��������ܼ���=167 kJmol-1+386 kJmol-1��4+498 kJmol-1-946 kJmol-1-460 kJmol-1��4=-577 kJmol-1��N2H4ȼ�յ��Ȼ�ѧ����ʽΪN2H4(g)+O2(g)�TN2(g)+2H2O(g)��H=-577 kJmol-1���ʴ�Ϊ��N2H4(g)+O2(g)�TN2(g)+2H2O(g) ��H=-577 kJmol-1��
(4)�ϳɰ�Ϊ���������С�ķ�Ӧ��ѹǿԽ�����ĺ���Խ�ߣ�����ͼ���֪���¶���ͬʱp2�����°����ĺ����ϸߣ��� pl��p2ѹǿ�Ĵ�С��ϵΪ pl��p2���ʴ�Ϊ��pl��p2��

����Ŀ��һ���¶��£������������Ϊ0.5 L�ĺ����ܱ������з�����Ӧ��CO(g)+Cl2(g)![]() COCl2(g)�������������з�Ӧ��5 minʱ�ﵽƽ��״̬��
COCl2(g)�������������з�Ӧ��5 minʱ�ﵽƽ��״̬��
������� | �¶�/�� | ��ʼ���ʵ���/mol | ƽ�����ʵ���/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
�� | 500 | 1.0 | 1.0 | 0 | 0.8 |
�� | 500 | 1.0 | a | 0 | 0.5 |
�� | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
����˵������ȷ����
A. ��������ǰ5 min��ƽ����Ӧ����v(CO)=0.16 mol��L-1��min-1
B. �÷�Ӧ����ӦΪ���ȷ�Ӧ
C. ����������ʼʱCl2�����ʵ���Ϊ0.55 mol
D. ����ʼʱ�����������CO0.8mol��Cl20.8mol���ﵽƽ��ʱCOת���ʴ���80%